Simulado ENEM | QUÍMICA | ENEM
SIMULADO ENEM | QUÍMICA
INSTRUÇÕES DESTE SIMULADO
OBJETIVOS DO SIMULADO
Aprimorar os conhecimentos adquiridos durante os seus estudos, de forma a avaliar a sua aprendizagem, utilizando para isso as metodologias e critérios idênticos aos maiores e melhores concursos públicos do País, através de simulado para ENEM, prova do ENEM e/ou questões do ENEM.
PÚBLICO ALVO DO SIMULADO
Alunos que almejam sua aprovação no ENEM. Que desejam tirar excelentes notas na prova do ENEM deste ano.
SOBRE AS QUESTÕES DO SIMULADO
Este simulado contém questões do ENEM e da banca INEP. Estas questões são especificamente para o Aluno ENEM , contendo QUÍMICA que foram extraídas de provas anteriores, portanto este simulado contém os gabaritos oficiais destas provas do ENEM.
ESTATÍSTICA DO SIMULADO
O simulado ENEM | QUÍMICA contém um total de 20 questões com um tempo estimado de 60 minutos para sua realização. O assunto abordado é diversificado para que você possa realmente simular como esta seus conhecimentos.
RANKING DO SIMULADO
Realize este simulado até o seu final e ao conclui-lo você verá as questões que errou e acertou, seus possíveis comentários e ainda poderá ver seu DESEMPENHO perante ao dos seus CONCORRENTES. Venha participar deste Ranking do ENEM e saia na frente de todos. Veja sua nota e sua colocação e saiba se esta preparado para conseguir sua aprovação.
Bons Estudos! Simulado para o ENEM é aqui!
- #89766
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
O Brasil tem investido em inovações tecnológicas para a produção e comercialização de maçãs. Um exemplo é a aplicação do composto volátil 1-metilciclopropeno, que compete pelos sítios de ligação do hormônio vegetal etileno nas células desse fruto.
Disponível em: http://revistaseletronicas.pucrs.br. Acesso em: 16 ago. 2012 (adaptado).
Com base nos conhecimentos sobre o efeito desse hormônio, o 1-metilciclopropeno age retardando o(a)
- a) formação do fruto.
- b) crescimento do fruto.
- c) amadurecimento do fruto.
- d) germinação das sementes.
- e) formação de sementes no fruto.
- #89767
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
Partículas beta, ao atravessarem a matéria viva, colidem com uma pequena porcentagem de moléculas e deixam atrás de si um rastro aleatoriamente pontilhado de radicais livres e íons quimicamente ativos. Essas espécies podem romper ainda outras ligações moleculares, causando danos celulares.
HEWITT, P. G. Física conceitual. Porto Alegre: Bookman, 2002 (adaptado).
A capacidade de gerar os efeitos descritos dá-se porque tal partícula é um
- a) elétron e, por possuir massa relativa desprezível, tem elevada energia cinética translacional.
- b) nêutron e, por não possuir carga elétrica, tem alta capacidade de produzir reações nucleares.
- c) núcleo do átomo de hélio (He) e, por possuir massa elevada, tem grande poder de penetração.
- d) fóton e, por não possuir massa, tem grande facilidade de induzir a formação de radicais livres.
- e) núcleo do átomo de hidrogênio (H) e, por possuir carga positiva, tem alta reatividade química.
- #89768
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
Grandes fontes de emissão do gás dióxido de enxofre são as indústrias de extração de cobre e níquel, em decorrência da oxidação dos minérios sulfurados. Para evitar a liberação desses óxidos na atmosfera e a consequente formação da chuva ácida, o gás pode ser lavado, em um processo conhecido como dessulfurização, conforme mostrado na equação (1 ).
CaCO3(s) + SO2 (g)  CaS03(s) + CO2 (g) (1)
CaS03(s) + CO2 (g) (1)
Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2 ). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 CaSO3(s) + O2(g)  2 CaS04(s) (2)
2 CaS04(s) (2)
As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
- a) 64.
- b) 108.
- c) 122 .
- d) 136.
- e) 245.
- #89769
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
Grande quantidade dos maus odores do nosso dia a dia está relacionada a compostos alcalinos. Assim, em vários desses casos, pode-se utilizar o vinagre, que contém entre 3,5% e 5% de ácido acético, para diminuir ou eliminar o mau cheiro. Por exemplo, lavar as mãos com vinagre e depois enxaguá-las com água elimina o odor de peixe, já que a molécula de piridina (C5H5N) é uma das substâncias responsáveis pelo odor característico de peixe podre.
SILVA, V. A.;BENITE, A.M.C.; SOARES , M. H.F.B. Algo aqui não cheira bem... A química do mau cheiro. Química Nova na Escola , v. 33, n.1, fev. 2011 (adaptado).
A eficiência do uso do vinagre nesse caso se explica pela
- a) sobreposição de odor, propiciada pelo cheiro característico do vinagre.
- b) solubilidade da piridina, de caráter ácido, na solução ácida empregada.
- c) inibição da proliferação das bactérias presentes, devido à ação do ácido acético.
- d) degradação enzimática da molécula de piridina, acelerada pela presença de ácido acético.
- e) reação de neutralização entre o ácido acético e a piridina, que resulta em compostos sem mau odor.
- #90000
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
O álcool comercial (solução de etanol) é vendido na concentração de 96%, em volume. Entretanto, para que possa ser utilizado como desinfetante, deve-se usar uma solução alcoólica na concentração de 70%, em volume. Suponha que um hospital recebeu como doação um lote de 1 000 litros de álcool comercial a 96%, em volume, e pretende trocá-lo por um lote de álcool desinfetante.
Para que a quantidade total de etanol seja a mesma nos dois lotes, o volume de álcool a 70% fornecido na troca deve ser mais próximo de
- a) 1 042 L.
- b) 1 371 L.
- c) 1 428 L.
- d) 1 632 L.
- e) 1 700 L.
- #90001
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
Em um caso de anemia, a quantidade de sulfato de ferro(ll) (FeS04, massa molar igual a 152 g/mol) recomendada como suplemento de ferro foi de 300 mg/dia. Acima desse valor, a mucosa intestinal atua como barreira, impedindo a absorção de ferro. Foram analisados cinco frascos de suplemento, contendo solução aquosa de FeSO4, cujos resultados encontram-se no quadro.
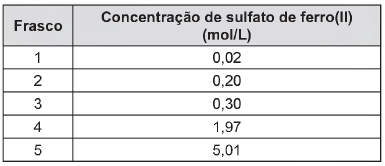
Se for ingerida uma colher (10 mL) por dia do medicamento para anemia, a amostra que conterá a concentração de sulfato de ferro(ll) mais próxima da recomendada é a do frasco de número
- a) 1.
- b) 2.
- c) 3.
- d) 4.
- e) 5.
- #90002
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
A água potável precisa ser límpida, ou seja, não deve conter partículas em suspensão, tais como terra ou restos de plantas, comuns nas águas de rios e lagoas. A remoção das partículas é feita em estações de tratamento, onde Ca(OH)2 em excesso e AI2(SO4)3 são adicionados em um tanque para formar sulfato de cálcio e hidróxido de alumínio. Esse último se forma como flocos gelatinosos insolúveis em água, que são capazes de agregar partículas em suspensão. Em uma estação de tratamento, cada 10 gramas de hidróxido de alumínio é capaz de carregar 2 gramas de partículas. Após decantação e filtração, a água límpida é tratada com cloro e distribuída para as residências. As massas molares dos elementos H, O, Al, S e Ca são, respectivamente, 1 g/mol, 16 g/mol, 27 g/mol, 32 g/mol e 40 g/mol.
Considerando que 1 000 litros da água de um rio possuem 45 gramas de partículas em suspensão, a quantidade mínima de AI2(SO4)3 que deve ser utilizada na estação de tratamento de água, capaz de tratar 3 000 litros de água de uma só vez, para garantir que todas as partículas em suspensão sejam precipitadas, é mais próxima de
- a) 59 g.
- b) 493 g.
- c) 987 g.
- d) 1 480 g.
- e) 2 960 g.
- #90003
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
Os bafômetros (etilômetros) indicam a quantidade de álcool, C2H6O (etanol), presente no organismo de uma pessoa através do ar expirado por ela. Esses dispositivos utilizam células a combustível que funcionam de acordo com as reações químicas representadas:
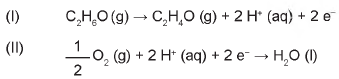
Na reação global de funcionamento do bafômetro, os reagentes e os produtos desse tipo de célula são
- a) o álcool expirado como reagente; água, elétrons e H+ como produtos.
- b) o oxigênio do ar e H+ como reagentes; água e elétrons como produtos.
- c) apenas o oxigênio do ar como reagente; apenas os elétrons como produto.
- d) apenas o álcool expirado como reagente; água, C2H4O e H+ como produtos.
- e) o oxigênio do ar e o álcool expirado como reagentes; água e C2H4O como produtos.
- #90004
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
A utilização de processos de biorremediação de resíduos gerados pela combustão incompleta de compostos orgânicos tem se tornado crescente, visando minimizar a poluição ambiental. Para a ocorrência de resíduos de naftaleno, algumas legislações limitam sua concentração em até 30 mg/kg para solo agrícola e 0,14 mg/L para água subterrânea. A quantificação desse resíduo foi realizada em diferentes ambientes, utilizando-se amostras de 500 g de solo e 100 mL de água, conforme apresentado no quadro.
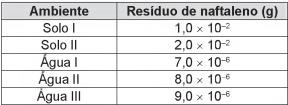
O ambiente que necessita de biorremediação é o(a)
- a) solo I.
- b) solo II.
- c) água I
- d) água II.
- e) água III.
- #90005
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
O estudo de compostos orgânicos permite aos analistas definir propriedades físicas e químicas responsáveis pelas características de cada substância descoberta. Um laboratório investiga moléculas quirais cuja cadeia carbônica seja insaturada, heterogênea e ramificada.
A fórmula que se enquadra nas características da molécula investigada é
- a) CH3 -(CH)2 -CH(OH)-CO-NH-CH3.
- b) CH3 -(CH)2 -CH(CH3 )-CO-NH-CH3.
- c) CH3 -(CH)2 -CH(CH3 )-CO-NH2.
- d) CH3 -CH2 -CH(CH3 )-CO-NH-CH3.
- e) C6H5 -CH2 -CO-NH-CH3.
- #90006
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
Um pesquisador percebe que o rótulo de um dos vidros em que guarda um concentrado de enzimas digestivas está ilegível. Ele não sabe qual enzima o vidro contém, mas desconfia de que seja uma protease gástrica, que age no estômago digerindo proteínas. Sabendo que a digestão no estômago é ácida e no intestino é básica, ele monta cinco tubos de ensaio com alimentos diferentes, adiciona o concentrado de enzimas em soluções com pH determinado e aguarda para ver se a enzima age em algum deles.
O tubo de ensaio em que a enzima deve agir para indicar que a hipótese do pesquisador está correta é aquele que contém
- a) cubo de batata em solução com pH = 9.
- b) pedaço de carne em solução com pH = 5.
- c) clara de ovo cozida em solução com pH = 9.
- d) porção de macarrão em solução com pH = 5.
- e) bolinha de manteiga em solução com pH = 9.
- #90007
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
Visando minimizar impactos ambientais, a legislação brasileira determina que resíduos químicos lançados diretamente no corpo receptor tenham pH entre 5,0 e 9,0. Um resíduo líquido aquoso gerado em um processo industrial tem concentração de íons hidroxila igual a 1,0 x 10-10 mol/L. Para atender a legislação, um químico separou as seguintes substâncias, disponibilizadas no almoxarifado da empresa: CH3COOH, Na2SO4 , CH3OH, K2CO3 e NH4Cl.
Para que o resíduo possa ser lançado diretamente no corpo receptor, qual substância poderia ser empregada no ajuste do pH?
- a) CH3COOH
- b) Na2SO4
- c) CH3OH
- d) K2 CO3
- e) NH4Cl
- #90008
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
A forma das moléculas, como representadas no papel, nem sempre é planar. Em um determinado fármaco, a molécula contendo um grupo não planar é biologicamente ativa, enquanto moléculas contendo substituintes planares são inativas.
O grupo responsável pela bioatividade desse fármaco é
- a)
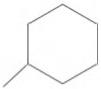
- b)
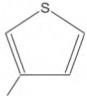
- c)
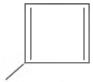
- d)
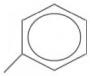
- e)
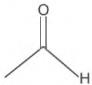
- #90009
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
A aplicação excessiva de fertilizantes nitrogenados na agricultura pode acarretar alterações no solo e na água pelo acúmulo de compostos nitrogenados, principalmente a forma mais oxidada, favorecendo a proliferação de algas e plantas aquáticas e alterando o ciclo do nitrogênio, representado no esquema. A espécie nitrogenada mais oxidada tem sua quantidade controlada por ação de microrganismos que promovem a reação de redução dessa espécie, no processo denominado desnitrificação.
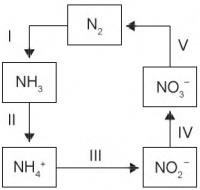
O processo citado está representado na etapa
- a) I.
- b) II.
- c) III.
- d) IV.
- e) V.
- #90010
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
A revelação das chapas de raios X gera uma solução que contém íons prata na forma de Ag(S2O3)23- . Para evitar a descarga desse metal no ambiente, a recuperação de prata metálica pode ser feita tratando eletroquimicamente essa solução com uma espécie adequada. O quadro apresenta semirreações de redução de alguns íons metálicos.

Das espécies apresentadas, a adequada para essa recuperação é
- a) Cu (s).
- b) Pt (s).
- c) Al 3+ (aq).
- d) Sn (s).
- e) Zn2+ (aq).

