Simulado ENEM | QUÍMICA | ENEM
SIMULADO ENEM | QUÍMICA
INSTRUÇÕES DESTE SIMULADO
OBJETIVOS DO SIMULADO
Aprimorar os conhecimentos adquiridos durante os seus estudos, de forma a avaliar a sua aprendizagem, utilizando para isso as metodologias e critérios idênticos aos maiores e melhores concursos públicos do País, através de simulado para ENEM, prova do ENEM e/ou questões do ENEM.
PÚBLICO ALVO DO SIMULADO
Alunos que almejam sua aprovação no ENEM. Que desejam tirar excelentes notas na prova do ENEM deste ano.
SOBRE AS QUESTÕES DO SIMULADO
Este simulado contém questões do ENEM e da banca INEP. Estas questões são especificamente para o Aluno ENEM , contendo QUÍMICA que foram extraídas de provas anteriores, portanto este simulado contém os gabaritos oficiais destas provas do ENEM.
ESTATÍSTICA DO SIMULADO
O simulado ENEM | QUÍMICA contém um total de 20 questões com um tempo estimado de 60 minutos para sua realização. O assunto abordado é diversificado para que você possa realmente simular como esta seus conhecimentos.
RANKING DO SIMULADO
Realize este simulado até o seu final e ao conclui-lo você verá as questões que errou e acertou, seus possíveis comentários e ainda poderá ver seu DESEMPENHO perante ao dos seus CONCORRENTES. Venha participar deste Ranking do ENEM e saia na frente de todos. Veja sua nota e sua colocação e saiba se esta preparado para conseguir sua aprovação.
Bons Estudos! Simulado para o ENEM é aqui!
- #89350
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
As lâmpadas fluorescentes apresentam vantagens como maior eficiência luminosa, vida útil mais longa e redução do consumo de energia. Contudo, um dos constituintes dessas lâmpadas é o mercúrio, que apresenta sérias restrições ambientais em função de sua toxicidade. Dessa forma, as lâmpadas fluorescentes devem passar por um processo prévio de descontaminação antes do descarte ou reciclagem do material. O ideal é que nesse processo se tenha o menor impacto ambiental e, se possível, o mercúrio seja recuperado e empregado em novos produtos.
DURÃO JR., W. A.; WINDMOLLER, C. C. A questão do mercúrio em lâmpadas fluorescentes. Química Nova na Escola, n. 28, 2008 (adaptado).
Considerando os impactos ambientais negativos, o processo menos indicado de descontaminação desse metal presente nas lâmpadas seria o(a)
- a) encapsulamento, no qual as lâmpadas são trituradas por via seca ou úmida, o material resultante é encapsulado em concreto e a disposição final do resíduo é armazenada em aterros.
- b) lixiviação ácida, com a dissolução dos resíduos sólidos das lâmpadas em ácido (HN03), seguida de filtração e neutralização da solução para recuperar os compostos de mercúrio.
- c) incineração, com a oxidação das lâmpadas junto com o lixo urbano em altas temperaturas, com redução do material sólido e lançamento dos gases e vapores para a atmosfera.
- d) processo térmico, no qual o resíduo é aquecido em sistema fechado para vaporizar o mercúrio e em seguida ocorre o resfriamento para condensar o vapor e obter o mercúrio elementar.
- e) separação por via química, na qual as lâmpadas são trituradas em sistema fechado, em seguida aditivos químicos são adicionados para precipitação e separação do mercúrio.
- #89351
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
A bauxita, composta por cerca de 50% de Al2O3, é o mais importante minério de alumínio. As seguintes etapas são necessárias para a obtenção de alumínio metálico:
1. A dissolução do AI2O3 (s) é realizada em solução de NaOH (aq) a 175 “C, levando à formação da espécie solúvel NaAI(OH)4 (aq).
2. Com o resfriamento da parte solúvel, ocorre a precipitação do AI(OH)3 (s).
3. Quando o AI(OH)3 (s) é aquecido a 1 050 “C, ele se decompõe em Al2O3 (s) e H2O.
4. Al2O3 (s) é transferido para uma cuba eletrolítica e fundido em alta temperatura com auxílio de um fundente.
5. Através da passagem de corrente elétrica entre os eletrodos da cuba eletrolítica, obtém-se o alumínio reduzido no cátodo.
As etapas 1, 3 e 5 referem-se, respectivamente, a fenômenos:
- a) Químico, físico e físico.
- b) Físico, físico e químico.
- c) Físico, químico e físico.
- d) Químico, físico e químico.
- e) Químico, químico e químico.
- #89352
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
O Conselho Nacional do Meio Ambiente (Conama) estabelece os limites máximos de chumbo, cádmio e mercúrio para as familiares pilhas e baterias portáteis comercializadas no território nacional e os critérios e padrões para o seu gerenciamento ambientalmente adequado. Os estabelecimentos que comercializam esses produtos, bem como a rede de assistência técnica autorizada, devem receber dos usuários as pilhas e baterias usadas para repasse aos respectivos fabricantes ou importadores.
Resolução Conama n. 401, de 4 de novembro de 2008. Disponível em: www.mma.gov.br. Acesso em: 14 maio 2013 (adaptado).
Do ponto de vista ambiental, a destinação final apropriada para esses produtos é
- a) direcionar as pilhas e baterias para compostagem.
- b) colocar as pilhas e baterias em um coletor de lixo seletivo.
- c) enviar as pilhas e baterias usadas para firmas de recarga.
- d) acumular as pilhas e baterias em armazéns de estocagem.
- e) destinar as pilhas e baterias à reutilização de seus componentes.
- #89353
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
O ferro metálico é obtido em altos-fornos pela mistura do minério hematita (?-Fe2O3) contendo impurezas, coque (C) e calcário (CaCO3), sendo estes mantidos sob um fluxo de ar quente que leva à queima do coque, com a temperatura no alto-forno chegando próximo a 2 000 °C. As etapas caracterizam o processo em função da temperatura.
Entre 200 °C e 700 °C:
3 Fe2O3 + CO ? 2 Fe3O4 + CO2
CaCO3 ? CaO + CO2
Fe3O4 + CO ? 3 FeO + CO2
Entre 700 °C e 1 200 °C:
C + CO2 ? 2 CO
FeO + CO ? Fe + CO2
Entre 1 200 °C e 2 000 °C:
Ferro impuro se funde
Formação de escória fundida (CaSiO3)
2 C + O2 ? 2 CO
BROWN, T L.; LEMAY, H. E.; BURSTEN, B. E. Química: a ciência central. São Paulo: Pearson Education, 2005 (adaptado).
No processo de redução desse metal, o agente redutor é o
- a) C.
- b) CO.
- c) CO2.
- d) CaO.
- e) CaCO3.
- #89354
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
Muitas indústrias e fábricas lançam para o ar, através de suas chaminés, poluentes prejudiciais às plantas e aos animais. Um desses poluentes reage quando em contato com o gás oxigênio e a água da atmosfera, conforme as equações químicas:
Equação 1: 2 SO2 + O2 —>2 SO3
Equação 2: SO3 + H2O —> H2SO4
De acordo com as equações, a alteração ambiental decorrente da presença desse poluente intensifica o(a)
- a) formação de chuva ácida.
- b) surgimento de ilha de calor.
- c) redução da camada de ozônio.
- d) ocorrência de inversão térmica.
- e) emissão de gases de efeito estufa.
- #89355
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
Uma das estratégias para conservação de alimentos é o salgamento, adição de cloreto de sódio (NaCI), historicamente utilizado por tropeiros, vaqueiros e sertanejos para conservar carnes de boi, porco e peixe.
O que ocorre com as células presentes nos alimentos preservados com essa técnica?
- a) O sal adicionado diminui a concentração de solutos em seu interior.
- b) O sal adicionado desorganiza e destrói suas membranas plasmáticas.
- c) A adição de sal altera as propriedades de suas membranas plasmáticas.
- d) Os íons Na+ e Cl- provenientes da dissociação do sal entram livremente nelas.
- e) A grande concentração de sal no meio extracelular provoca a saída de água de dentro delas.
- #89356
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
Células solares à base de TiO2 sensibilizadas por corantes (S) são promissoras e poderão vir a substituir as células de silício. Nessas células, o corante adsorvido sobre o TiO2 é responsável por absorver a energia luminosa (hv), e o corante excitado (S*) é capaz de transferir elétrons para o TiO2. Um esquema dessa célula e os processos envolvidos estão ilustrados na figura. A conversão de energia solar em elétrica ocorre por meio da sequência de reações apresentadas.
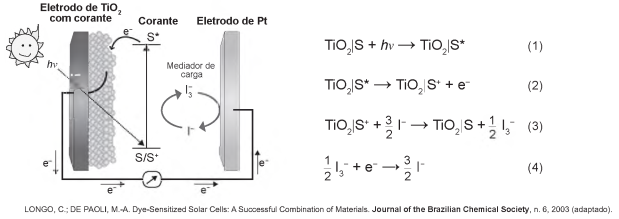
A reação 3 é fundamental para o contínuo funcionamento da célula solar, pois
- a) reduz íons I- a I3-.
- b) regenera o corante.
- c) garante que a reação 4 ocorra.
- d) promove a oxidação do corante.
- e) transfere elétrons para o eletrodo de TiO2.
- #89357
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
Por meio de reações químicas que envolvem carboidratos, lipídeos e proteínas, nossas células obtêm energia e produzem gás carbônico e água. A oxidação da glicose no organismo humano libera energia, conforme ilustra a equação química, sendo que aproximadamente 40% dela é disponibilizada para atividade muscular.
C6H12O6( s ) + 6 O2 (g) ? 6 CO2 (g) + 6 H2O (I) ?cH= -2 800 kJ
Considere as massas molares (em g mol-1): H = 1; C=12; O = 16.
LIMA, L. M.; FRAGA, C.A. M.; BARREIRO, E. J. Química na saúde. São Paulo: Sociedade Brasileira de Química, 2010 (adaptado).
Na oxidação de 1,0 grama de glicose, a energia obtida para atividade muscular, em quilojoule, é mais próxima de
- a) 6,2.
- b) 15,6.
- c) 70,0.
- d) 622,2.
- e) 1 120,0.
- #89358
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
A hidroxilamina (NH2OH) é extremamente reativa em reações de substituição nucleofílica, justificando sua utilização em diversos processos. A reação de substituição nucleofílica entre o anidrido acético e a hidroxilamina está representada.
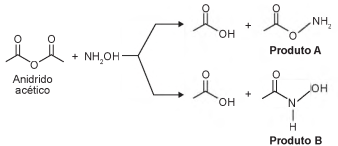
O produto A é favorecido em relação ao B, por um fator de 105. Em um estudo de possível substituição do uso de hidroxilamina, foram testadas as móleculas numeradas de 1 a 5 .
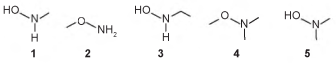
Dentre as moléculas testadas, qual delas apresentou menor reatividade?
- a) 1
- b) 2
- c) 3
- d) 4
- e) 5
- #89359
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
Na mitologia grega, Nióbia era a filha de Tântalo, dois personagens conhecidos pelo sofrimento. O elemento químico de número atômico (Z) igual a 41 tem propriedades químicas e físicas tão parecidas com as do elemento de número atômico 73 que chegaram a ser confundidos. Por isso, em homenagem a esses dois personagens da mitologia grega, foi conferido a esses elementos os nomes de nióbio (Z = 41) e tântalo (Z = 73). Esses dois elementos químicos adquiriram grande importância econômica na metalurgia, na produção de supercondutores e em outras aplicações na indústria de ponta, exatamente pelas propriedades químicas e físicas comuns aos dois.
KEAN, S. A colher que desaparece: e outras histórias reais de loucura, amor e morte a partir dos elementos químicos. Rio de Janeiro: Zahar, 2011 (adaptado).
A importância econômica e tecnológica desses elementos, pela similaridade de suas propriedades químicas e físicas, deve-se a
- a) terem elétrons no subnível f.
- b) serem elementos de transição interna.
- c) pertencerem ao mesmo grupo na tabela periódica.
- d) terem seus elétrons mais externos nos níveis 4 e 5, respectivamente.
- e) estarem localizados na família dos alcalinos terrosos e alcalinos, respectivamente.
- #89360
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
A identificação de riscos de produtos perigosos para o transporte rodoviário é obrigatória e realizada por meio da sinalização composta por um painel de segurança, de cor alaranjada, e um rótulo de risco. As informações inseridas no painel de segurança e no rótulo de risco, conforme determina a legislação, permitem que se identifique o produto transportado e os perigos a ele associados.
A sinalização mostrada identifica uma substância que está sendo transportada em um caminhão.

Os três algarismos da parte superior do painel indicam o “Número de risco”. O número 268 indica tratar-se de um gás (2), tóxico (6) e corrosivo (8). Os quatro dígitos da parte inferior correspondem ao “Número ONU”, que identifica o produto transportado.
BRASIL. Resolução n. 420, de 12/02/2004, da Agência Nacional de Transportes Terrestres (ANTT)/Ministério dos Transportes (adaptado).
ABNT. NBR 7500: identificação para o transporte terrestre, manuseio, movimentação e armazenamento de produtos. Rio de Janeiro, 2004 (adaptado).
Considerando a identificação apresentada no caminhão, o código 1005 corresponde à substância
- a) eteno (C2H4)
- b) nitrogênio (N2).
- c) amônia (NH3).
- d) propano (C3H8).
- e) dióxido de carbono (CO2).
- #89361
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
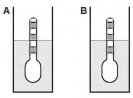
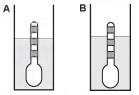
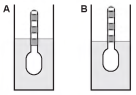
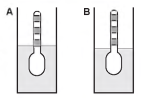
Usando um densímetro cuja menor divisão da escala, isto é, a diferença entre duas marcações consecutivas, é de 5,0 x 10-2 g cm-3, um estudante realizou um teste de densidade: colocou este instrumento na água pura e observou que ele atingiu o repouso na posição mostrada.
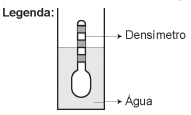
Em dois outros recipientes A e B contendo 2 litros de água pura, em cada um, ele adicionou 100 g e 200 g de NaCl, respectivamente.
Quando o cloreto de sódio é adicionado à água pura ocorre sua dissociação formando os íons Na+ e Cl-. Considere que esses íons ocupam os espaços intermoleculares na solução.
Nestes recipientes, a posição de equilíbrio do densímetro está representada em:
- a)
- b)

- c)
- d)
- e)
- #89362
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
Em 1938 o arqueólogo alemão Wilhelm Konig, diretor do Museu Nacional do Iraque, encontrou um objeto estranho na coleção da instituição, que poderia ter sido usado como uma pilha, similar às utilizadas em nossos dias. A suposta pilha, datada de cerca de 200 a.C., é constituída de um pequeno vaso de barro (argila) no qual foram instalados um tubo de cobre, uma barra de ferro (aparentemente corroída por ácido) e uma tampa de betume (asfalto), conforme ilustrado. Considere os potenciais-padrão de redução:  (Fe2+|Fe) = -0,44 V;
(Fe2+|Fe) = -0,44 V;  (H+|H2) = 0,00 V; e
(H+|H2) = 0,00 V; e  (Cu2+|Cu) = +0,34 V.
(Cu2+|Cu) = +0,34 V.

Nessa suposta pilha, qual dos componentes atuaria como cátodo?
- a) A tampa de betume.
- b) O vestígio de ácido.
- c) A barra de ferro.
- d) O tubo de cobre.
- e) O vaso de barro.
- #89363
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
O carro flex é uma realidade no Brasil. Estes veículos estão equipados com motor que tem a capacidade de funcionar com mais de um tipo de combustível. No entanto, as pessoas que têm esse tipo de veículo, na hora do abastecimento, têm sempre a dúvida: álcool ou gasolina? Para avaliar o consumo desses combustíveis, realizou-se um percurso com um veículo flex, consumindo 40 litros de gasolina e no percurso de volta utilizou-se etanol. Foi considerado o mesmo consumo de energia tanto no percurso de ida quanto no de volta.
O quadro resume alguns dados aproximados sobre esses combustíveis.

O volume de etanol combustível, em litro, consumido no percurso de volta é mais próximo de
- a) 27.
- b) 32.
- c) 37.
- d) 58.
- e) 67.
- #89364
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
Pesquisas demonstram que nanodispositivos baseados em movimentos de dimensões atômicas, induzidos por luz, poderão ter aplicações em tecnologias futuras, substituindo micromotores, sem a necessidade de componentes mecânicos. Exemplo de movimento molecular induzido pela luz pode ser observado pela flexão de uma lâmina delgada de silício, ligado a um polímero de azobenzeno eaum material suporte, em dois comprimentos de onda, conforme ilustrado na figura. Com a aplicação de luz ocorrem reações reversíveis da cadeia do polímero, que promovem o movimento observado.
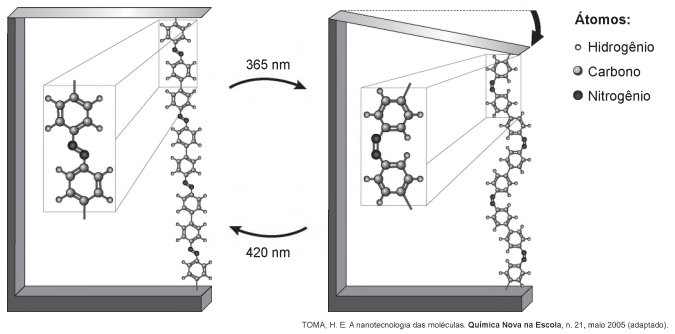
O fenômeno de movimento molecular, promovido pela incidência de luz, decorre do(a)
- a) movimento vibracional dos átomos, que leva ao encurtamento e à relaxação das ligações.
- b) isomerização das ligações N=N, sendo a forma cis do polímero mais compacta que a trans.
- c) tautomerização das unidades monoméricas do polímero, que leva a um composto mais compacto.
- d) ressonância entre os elétrons π do grupo azo e os do anel aromático que encurta as ligações duplas.
- e) variação conformacional das ligações N=N, que resulta em estruturas com diferentes áreas de superfície.

