Simulado ENEM | QUÍMICA | ENEM
📚 Simulado ENEM | Aluno ENEM | cód.6391
Você está a um simulado de distância da sua melhor versão. Treine para o concurso ENEM! 💡
🎯 São milhares de simulados para concurso disponíveis para você praticar e conseguir a tão sonhada aprovação em Concurso Público.
🧪 Este Simulado ENEM foi elaborado da seguinte forma:
- 📌 Categoria: Enem
- 🏛️ Instituição: ENEM
- 👔 Cargo: Aluno ENEM
- 📚 Matéria: Química
- 🧩 Assuntos do Simulado:
- 🏢 Banca Organizadora: INEP
- ❓ Quantidade de Questões: 20
- ⏱️ Tempo do Simulado: 60 minutos
⚙️ REGRA DO SIMULADO
Este simulado é gratuito 🆓. Basta clicar no botão iniciar abaixo e preencher um breve cadastro para participar do nosso ranking.
📊 No ranking você compara sua nota com outros candidatos e acompanha sua evolução nos estudos.
🚀 Aproveite este simulado ENEM e saia na frente na sua preparação!
📖 Questões ENEM
Se ainda não estiver pronto para fazer o simulado, treine antes com nossas questões de concursos:
🎥 Vídeo Aula
Confira vídeo aulas no YouTube com foco no concurso ENEM. Estude com conteúdo gratuito e atualizado.
Assistir vídeo aula sobre ENEM
📚 Apostila
Encontre apostilas completas e materiais didáticos atualizados para o concurso ENEM.
📢 Concursos Abertos para ENEM
Veja os concursos abertos da instituição ENEM. A lista está sempre atualizada:
🍀 Boa sorte e Bons Estudos,
ConcursosAZ - Aprovando de A a Z ✅
- #88753
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
O papel tem na celulose sua matéria-prima, e uma das etapas de sua produção é o branqueamento, que visa remover a lignina da celulose. Diferentes processos de branqueamento usam, por exemplo, cloro (Cl2 ), hipoclorito de sódio (NaClO), oxigênio (O2 ), ozônio (O3 ) ou peróxido de hidrogênio (H2O2 ). Alguns processos de branqueamento levam à formação de compostos organoclorados. São apresentadas as estruturas de um fragmento da lignina e do tetracloroguaiacol, um dos organoclorados formados no processo de branqueamento.
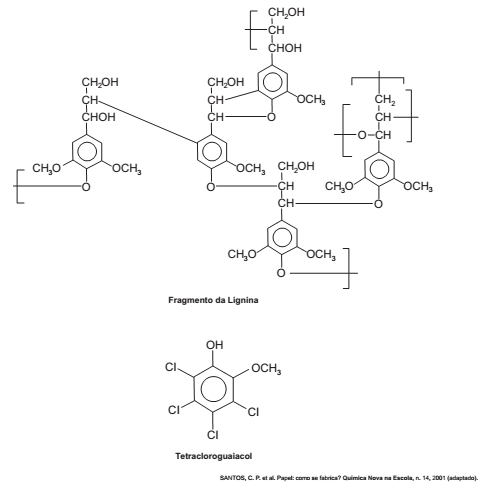
Os reagentes capazes de levar à formação de organoclorados no processo citado são
- a) O2 e O3 .
- b) Cl2 e O2 .
- c) H2O2 e Cl2 .
- d) NaClO e O3 .
- e) NaClO e Cl2 .
- #88754
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
A química verde permite o desenvolvimento tecnológico com danos reduzidos ao meio ambiente, e encontrar rotas limpas tem sido um grande desafio. Considere duas rotas diferentes utilizadas para a obtenção de ácido adípico, um insumo muito importante para a indústria têxtil e de plastificantes.
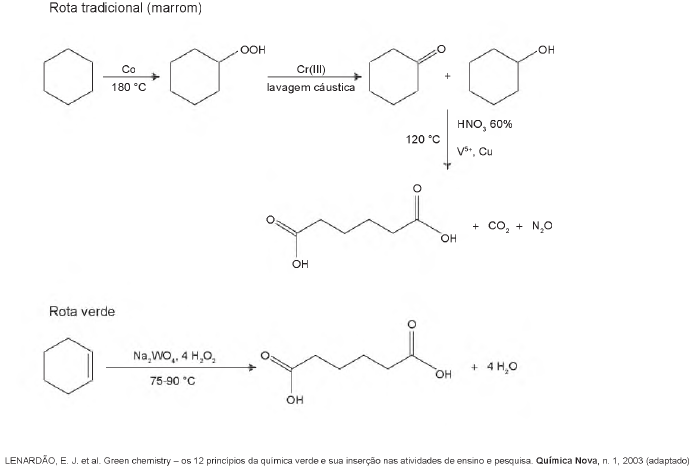
Que fator contribui positivamente para que a segunda rota de síntese seja verde em comparação à primeira?
- a) Etapa única na síntese.
- b) Obtenção do produto puro.
- c) Ausência de reagentes oxidantes.
- d) Ausência de elementos metálicos no processo.
- e) Gasto de energia nulo na separação do produto.
- #88755
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
O aproveitamento de resíduos florestais vem se tornando cada dia mais atrativo, pois eles são uma fonte renovável de energia. A figura representa a queima de um bio-óleo extraído do resíduo de madeira, sendo ?H1 a variação de entalpia devido à queima de 1 g desse bio-óleo, resultando em gás carbônico e água líquida, e ?H2 a variação de entalpia envolvida na conversão de 1 g de água no estado gasoso para o estado líquido.
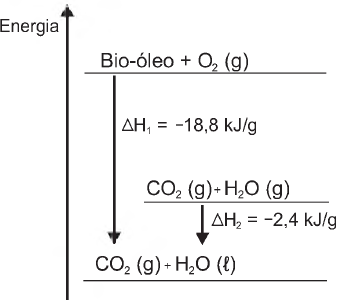
A variação de entalpia, em kJ, para a queima de 5 g desse bio-óleo resultando em CO2 (gasoso) e H2O (gasoso) é:
- a) -106.
- b) -94,0.
- c) - 82,0.
- d) - 21,2.
- e) -16,4.
- #88756
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
Pesticidas são substâncias utilizadas para promover o controle de pragas. No entanto, após sua aplicação em ambientes abertos, alguns pesticidas organoclorados são arrastados pela água até lagos e rios e, ao passar pelas guelras dos peixes, podem difundir-se para seus tecidos lipídicos e lá se acumularem.
A característica desses compostos, responsável pelo processo descrito no texto, é o(a)
- a) baixa polaridade.
- b) baixa massa molecular.
- c) ocorrência de halogênios.
- d) tamanho pequeno das moléculas.
- e) presença de hidroxilas nas cadeias.
- #88759
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
Vários ácidos são utilizados em indústrias que descartam seus efluentes nos corpos d'água, como rios e lagos, podendo afetar o equilíbrio ambiental. Para neutralizar a acidez, o sal carbonato de cálcio pode ser adicionado ao efluente, em quantidades apropriadas, pois produz bicarbonato, que neutraliza a água. As equações envolvidas no processo são apresentadas:
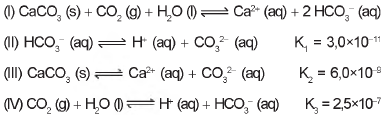
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25 “C, qual é o valor numérico da constante de equilíbrio da reação I?
- a) 4,5x10-26
- b) 5,0x10-5
- c) 0,8x10-9
- d) 0,2x105
- e) 2,2x1026
- #88768
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
A soda cáustica pode ser usada no desentupimento de encanamentos domésticos e tem, em sua composição, o hidróxido de sódio como principal componente, além de algumas impurezas. A soda normalmente é comercializada na forma sólida, mas que apresenta aspecto “derretido" quando exposta ao ar por certo período.
O fenômeno de “derretimento" decorre da
- a) absorção da umidade presente no ar atmosférico.
- b) fusão do hidróxido pela troca de calor com o ambiente.
- c) reação das impurezas do produto com o oxigênio do ar.
- d) adsorção de gases atmosféricos na superfície do sólido.
- e) reação do hidróxido de sódio com o gás nitrogênio presente no ar.
- #88772
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
O cobre, muito utilizado em fios da rede elétrica e com considerável valor de mercado, pode ser encontrado na natureza na forma de calcocita, Cu2S (s), de massa molar 159 g/mol. Por meio da reação Cu2S (s) + O2(g)  2 Cu (s) + S02 (g), é possível obtê-lo na forma metálica.
2 Cu (s) + S02 (g), é possível obtê-lo na forma metálica.
A quantidade de matéria de cobre metálico produzida a partir de uma tonelada de calcocita com 7,95% (m/m) de pureza é
- a) 1,0 X 103 mol.
- b) 5,0 X 102 mol.
- c) 1,0 X 100 mol.
- d) 5,0 X 10-1 mol;
- e) 4,0 X 10-3 mol.
- #88777
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
Água dura é aquela que contém concentrações relativamente altas de íons Ca2+ e Mg2+ dissolvidos. Apesar de esses íons não representarem risco para a saúde, eles podem tornar a água imprópria para alguns tipos de consumo doméstico ou industrial. Objetivando reduzir a concentração de íons Ca2+ e Mg2+ de uma amostra de água dura ao mínimo possível, um técnico em química testou os seguintes procedimentos no laboratório:
I - Decantação da amostra de água.
II - Filtração da amostra de água.
III - Aquecimento da amostra de água.
IV - Adição do solvente orgânico CCl4 à amostra de água.
V - Adição de CaO e Na2CO3 à amostra de água.
BROWN, T L. et al. Química, a ciência central. São Paulo: Pearson Prentice Hall, 2005 (adaptado).
O método considerado viável para tratar a água dura e aumentar seu potencial de utilização é o(a)
- a) decantação, pois permite que esses íons se depositem no fundo do recipiente.
- b) filtração, pois assim os íons Ca2+ e Mg2+ são retidos no filtro e separados da água.
- c) aquecimento da amostra de água, para que esses íons sejam evaporados e separados.
- d) adição do solvente orgânico CCl4 à amostra, para solubilizar esses íons e separá-los da água.
- e) reação química com CaO e Na2CO3, para precipitar esses íons na forma de compostos insolúveis.
- #88779
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
Um engenheiro decidiu instalar um aquecedor solar em sua casa, conforme mostra o esquema.
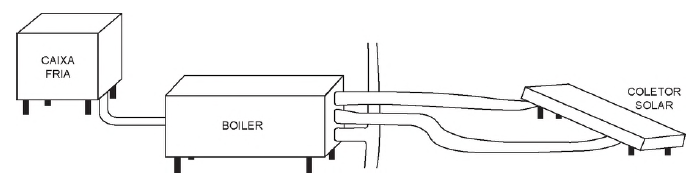
De acordo com as instruções de montagem, para se ter um aproveitamento máximo da incidência solar, as placas do coletor solar devem ser instaladas com um ângulo de inclinação determinado.
O parâmetro que define o valor do ângulo de inclinação dessas placas coletoras é a
- a) altitude.
- b) latitude.
- c) longitude.
- d) nebulosidade.
- e) umidade relativa do ar.
- #88780
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
O principal processo industrial utilizado na produção de fenol é a oxidação do cumeno (isopropilbenzeno). A equação mostra que esse processo envolve a formação do hidroperóxido de cumila, que em seguida é decomposto em fenol e acetona, ambos usados na indústria química como precursores de moléculas mais complexas. Após o processo de síntese, esses dois insumos devem ser separados para comercialização individual.
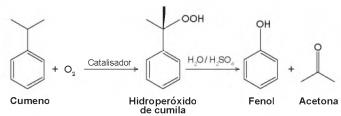
Considerando as características físico-químicas dos dois insumos formados, o método utilizado para a separação da mistura, em escala industrial, é a
- a) filtração.
- b) ventilação.
- c) decantação.
- d) evaporação.
- e) destilação fracionada.
- #88781
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
A elevação da temperatura das águas de rios, lagos e mares diminui a solubilidade do oxigênio, pondo em risco as diversas formas de vida aquática que dependem desse gás. Se essa elevação de temperatura acontece por meios artificiais, dizemos que existe poluição térmica. As usinas nucleares, pela própria natureza do processo de geração de energia, podem causar esse tipo de poluição.
Que parte do ciclo de geração de energia das usinas nucleares está associada a esse tipo de poluição?
- a) Fissão do material radioativo.
- b) Condensação do vapor-d’água no final do processo.
- c) Conversão de energia das turbinas pelos geradores.
- d) Aquecimento da água líquida para gerar vapor-d'água.
- e) Lançamento do vapor-d'água sobre as pás das turbinas.
- #88782
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
Para impedir a contaminação microbiana do suprimento de água, deve-se eliminar as emissões de efluentes e, quando necessário, tratá-lo com desinfetante. O ácido hipocloroso (HClO), produzido pela reação entre cloro e água, é um dos compostos mais empregados como desinfetante. Contudo, ele não atua somente como oxidante, mas também como um ativo agente de cloração. A presença de matéria orgânica dissolvida no suprimento de água clorada pode levar à formação de clorofórmio (CHCl3) e outras espécies orgânicas cloradas tóxicas.
SPIRO, T. G.; STIGLIANI, W. M. Química ambiental. São Paulo: Pearson, 2009 (adaptado).
Visando eliminar da água o clorofórmio e outras moléculas orgânicas, o tratamento adequado é a
- a) filtração, com o uso de filtros de carvão ativo.
- b) fluoretação, pela adição de fluoreto de sódio.
- c) coagulação, pela adição de sulfato de alumínio.
- d) correção do pH, pela adição de carbonato de sódio.
- e) floculação, em tanques de concreto com a água em movimento.
- #88783
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
Industrialmente é possível separar os componentes do ar, utilizando-se uma coluna de fracionamento. Com este processo, obtêm-se gases como: oxigênio (O2), nitrogênio (N2) e argônio (Ar). Nesse processo o ar é comprimido e se liquefaz; em seguida ele é expandido, volta ao estado gasoso e seus componentes se separam um a um.
A ordem de separação dos gases na coluna de fracionamento está baseada em qual propriedade da matéria?
- a) Na densidade dos gases, ou seja, o menos denso separa-se primeiro.
- b) Na pressão parcial dos gases, ou seja, o gás com menor pressão parcial separa-se primeiro.
- c) Na capacidade térmica dos gases, ou seja, o gás que mais absorve calor separa-se primeiro.
- d) Na condutividade térmica dos gases, ou seja, o gás que mais rápido absorve calor separa-se primeiro.
- e) Na temperatura de ebulição dos gases, ou seja, o gás com menor temperatura de ebulição separa-se primeiro.
- #88904
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
A qualidade de óleos de cozinha, compostos principalmente por moléculas de ácidos graxos, pode ser medida pelo índice de iodo. Quanto maior o grau de insaturação da molécula, maior o índice de iodo determinado e melhor a qualidade do óleo. Na figura, são apresentados alguns compostos que podem estar presentes em diferentes óleos de cozinha:
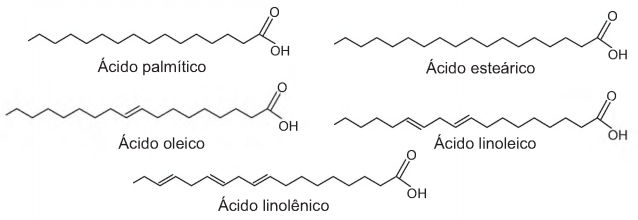
Dentre os compostos apresentados, os dois que proporcionam melhor qualidade para os óleos de cozinha são os ácidos
- a) esteárico e oleico.
- b) linolênico e linoleico.
- c) palmítico e esteárico.
- d) palmítico e linolênico.
- e) linolênico e esteárico.
- #88907
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
À medida que se expira sobre uma solução de azul de bromotimol e hidróxido de sódio (NaOH), sua coloração azul característica vai se alterando. O azul de bromotimol é um indicador ácido-base que adquire cor azul em pH básico, verde em pH neutro e amarela em pH ácido. O gás carbônico (CO2) expirado reage com a água presente na solução (H2O), produzindo ácido carbônico (H2CO3). Este pode reagir com o NaOH da solução inicial, produzindo bicarbonato de sódio (NaHCO3):
CO2 + H2O ? H2CO3
H2CO3 + NaOH ? NaHCO3 + H2O
ARROIO, A. et al. Química Nova na Escola, São Paulo, v. 29, 2006.
O que a pessoa irá observar à medida que expira no recipiente contendo essa solução?
- a) A solução mudará de cor, de azul para verde, e, em seguida, de verde para amarelo. Com o acréscimo de ácido carbônico, o pH da solução irá reduzir até tornar-se neutro. Em seguida, um excesso de ácido carbônico tornará o pH da solução ácido.
- b) A solução somente terá sua cor alterada de azul para amarelo, pois será formado um excesso de ácido carbônico no recipiente, o que reduzirá bruscamente o pH da solução.
- c) A cor da solução não será alterada com o acréscimo de ácido carbônico. Isso porque o meio é inicialmente neutro e a presença de ácido carbônico não produzirá nenhuma mudança no pH da solução.
- d) A solução mudará de azul para verde e, em seguida, de verde para azul. Isso ocorrerá em função da neutralização de um meio inicialmente básico acompanhado de um aumento de pH na solução, à medida que ácido carbônico é adicionado ao meio.
- e) A cor da solução alterará de azul para amarelo e, em seguida, de amarelo para verde. Esse comportamento é justificado pelo fato de o ácido carbônico reduzir bruscamente o pH da solução e depois ser neutralizado pelo restante de NaOH presente no meio.

