Funções Inorgânicas
Funções Inorgânicas
Funções inorgânicas são compostos químicos, e são chamados assim porque não possuem cadeias carbônicas em sua composição portanto, não são considerados compostos orgânicos.
São substâncias químicas que são agrupadas em famílias porque possuem propriedades semelhantes. Eles diferem apenas no comportamento que apresentam quando em contato com a água.
Funções inorgânicas são os grupos de substâncias químicas que não apresentam como elemento químico central o carbono (já que as substâncias que o apresentam pertencem às funções orgânicas), ou seja, fazem parte da Química Inorgânica. As principais são: Ácidos, Bases, Sais e Óxidos
VEJA TAMBÉM
- Quais são as funções inorgânicas?
- Funções inorgânicas exemplos
- Funções inorgânicas: sais
- Funções inorgânicas exercícios
- Funções inorgânicas: ácidos, bases, sais e óxidos
- Novos Simulados Enem
- Novas Questões Enem
- Provas Anteriores Enem

Quais são as funções inorgânicas?
As principais funções inorgânicas são os ácidos, as base, os óxidos e os sais. Esses compostos pertencem à Química Inorgânica e não possuem o elemento carbono disposto em cadeias
Funções inorgânicas exemplos
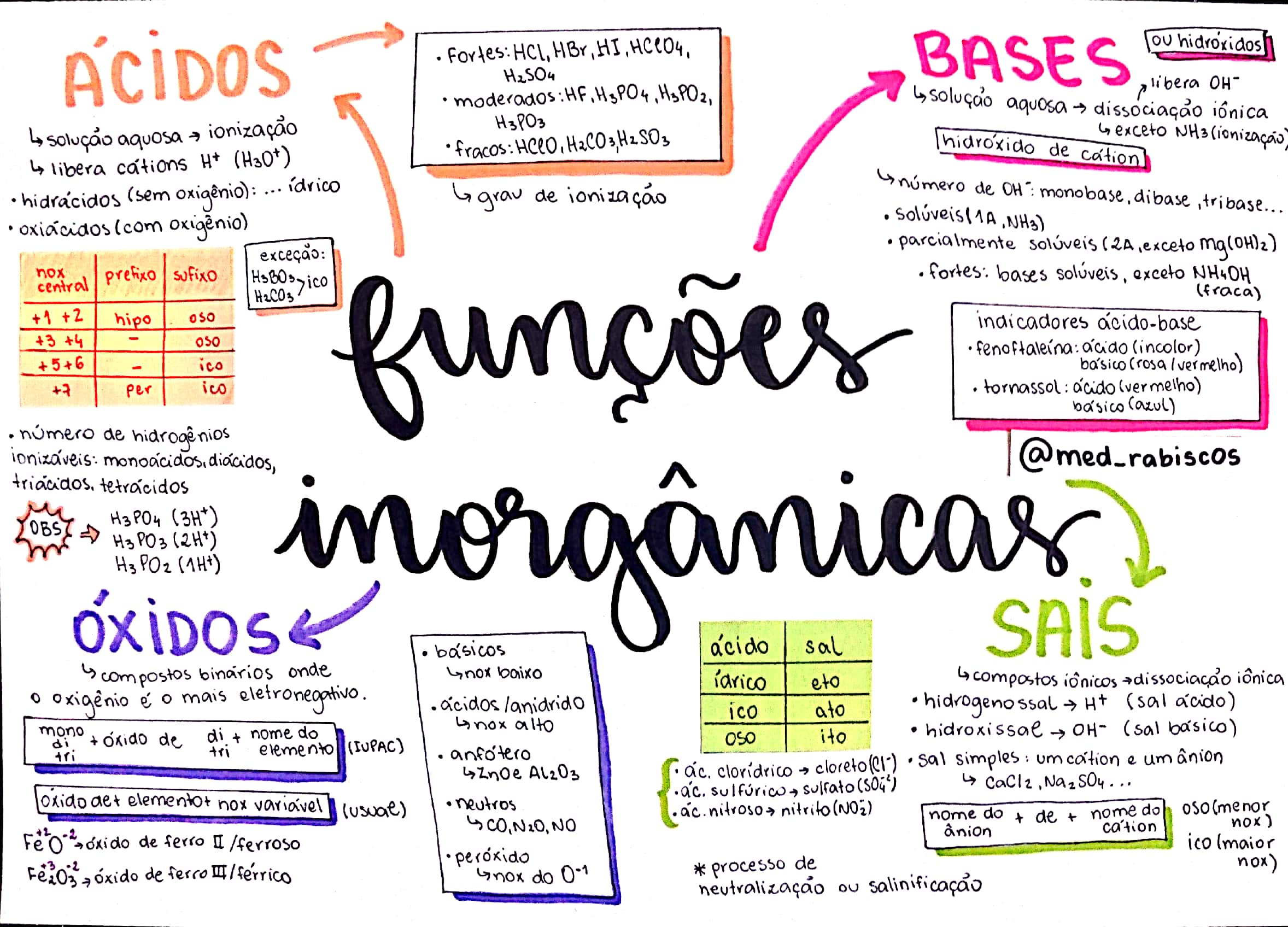
Ácidos: São compostos covalentes que reagem com água (sofrem ionização) e formam soluções que apresentam como único cátion o hidrônio (H3O1+) ou, conforme o conceito original e que permanece até hoje para fins didáticos, o cátion
H1+. H2SO4 → H3O1+ + HSO41- ou H2SO4 → H1+ + HSO4-
HCl → H3O1+ + Cl1- ou HCl → H1+ + Cl1-
Bases são compostos capazes de dissociar-se na água, liberando íons, mesmo em pequena porcentagem, e o único ânion liberado é o hidróxido (OH1-).
"NaOH(s) → Na1+ + OH1-
Ca(OH)2 → Ca2+ + 2 OH1-"
Sais são compostos capazes de se dissociar na água, liberando íons, mesmo em pequena porcentagem, dos quais pelo menos um cátion é diferente de H3O1+ e pelo menos um ânion é diferente de OH1-.
NaCl → Na1+ + Cl1-
Ca(NO3)2 → Ca2+ + 2 NO31-
(NH4)3PO4 → 3 NH4+1 + PO43-
Óxidos são compostos binários (formados por apenas dois elementos químicos), e o oxigênio é o elemento mais eletronegativo.
CO2, SO2, SO3, P2O5, Cl2O6, NO2, N2O4, Na2O
Funções inorgânicas: sais
Os sais são substâncias parecidas com os ácidos e as bases, pois liberam íons em contato com a água. São formados a partir da neutralização de um ácido por uma base. Essa reação pode ser chamada de reação de neutralização ou salinização, na qual são liberados um sal e uma molécula de água. O sal é um composto feito de um ânion e um cátion diferentes de H+ e OH–.
Funções inorgânicas exercícios
I- Considerando a equação química:
Cl2O7 + 2 NaOH → 2 NaClO4 + H2O
os reagentes e produtos pertencem, respectivamente, às funções:
a) óxido, base, sal e óxido.
b) sal, base, sal e hidreto.
c) ácido, sal, óxido e hidreto.
d) óxido, base, óxido e hidreto.
e) base, ácido, óxido e óxido.
resposta: Alternativa (A)
II- Uma substância pura é sólida em temperatura ambiente, apresenta elevadas temperaturas de fusão e de ebulição e conduz corrente elétrica tanto fundida como dissolvida em água. Indique a alternativa cuja substância apresenta as propriedades citadas:
a) SO3.
b) SO2.
c) NH3.
d) H2SO4.
e) Na2SO4.
resposta Alternativa (E)
Funções inorgânicas: ácidos, bases, sais e óxidos
Ácidos: o primeiro elemento do composto é um hidrogênio. Exemplo: ácido cítrico (C6H8O7) e ácido fluorídrico (HF)
Bases: o OH (hidroxila) é último elemento do composto. Exemplo: hidróxido de sódio ou soda cáustica (NaOH) e hidróxido de prata (AgOH)
Óxidos: composto com dois elementos (diatômico), no qual o último é oxigênio. Exemplo: monóxido de carbono (CO) e óxido de cálcio ou cal (CaO)
Sais: o primeiro elemento do composto é um metal e o segundo um não-metal. Exemplo: cloreto de sódio (NaCl) e bicarbonato de sódio (NaHCO3).
FONTES: mundoeduca/ wikipédia/ educa+brasil

