Simulado Química Enem | ENEM
SIMULADO QUÍMICA ENEM
INSTRUÇÕES DO SIMULADO
OBJETIVOS
Aprimorar os conhecimentos adquiridos durante os seus estudos, de forma a avaliar a sua aprendizagem, utilizando para isso as metodologias e critérios idênticos aos maiores e melhores do País, através de simulados para , provas e questões de .
PÚBLICO ALVO DO SIMULADO
Alunos/Concursando que almejam sua aprovação no ENEM.
SOBRE AS QUESTÕES DO SIMULADO
Este simulado contém questões da ENEM que foi organizado pela bancas diversas. Estas questões são de Química, contendo os assuntos de Assuntos Diversos que foram extraídas dos anteriores ENEM, portanto este simulado contém os gabaritos oficiais.
ESTATÍSTICA DO SIMULADO
O Simulado Química Enem contém um total de 10 questões de com um tempo estimado de 30 minutos para sua realização. Os assuntos abordados são de Química, Assuntos Diversos para que você possa realmente simular como estão seus conhecimento no ENEM.
RANKING DO SIMULADO
Realize este simulado até o seu final e ao conclui-lo você verá as questões que errou e acertou, seus possíveis comentários e ainda poderá ver seu DESEMPENHO perante ao dos seus CONCORRENTES no ENEM. Venha participar deste Ranking e saia na frente de todos. Veja sua nota e sua colocação no RANKING e saiba se esta preparado para conseguir sua aprovação.
CARGO DO SIMULADO
Este simulado contém questões para o cargo de Aluno ENEM. Se você esta estudando para ser aprovado para Aluno ENEM não deixe de realizar este simulado e outros disponíveis no portal.
COMO REALIZAR O SIMULADO ENEM
Para realizar o simulado ENEM você deve realizar seu cadastro grátis e depois escolher as alternativas que julgar correta. No final do simulado ENEM você verá as questões que errou e acertou.
Bons Estudos! Simulado para ENEM é aqui!
- #206059
- Banca
- . Bancas Diversas
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
As vezes, ao abrir um refrigerante, percebe-se que uma parte do produto vaza rapidamente pela extremidade do recipiente. A explicação para esse fato está relacionada à perturbação do equilíbrio químico existente entre alguns dos ingredientes do produto, de acordo com a equação:
CO2(g) + H2O(I) ⥨ H2CO3(aq)
A alteração do equilíbrio anterior, relacionada ao vazamento do refrigerante nas condições descritas, tem como consequência a
- a) liberação de CO2 para o ambiente.
- b) elevação da temperatura do recipiente.
- c) elevação da pressão interna no recipiente.
- d) elevação da concentração de CO2 no líquido.
- e) formação de uma quantidade significativa de H2O.
- #206061
- Banca
- . Bancas Diversas
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
Um problema ainda não resolvido da geração nuclear de eletricidade é a destinação dos rejeitos radiativos, o chamado “lixo atômico”. Os rejeitos mais ativos ficam por um período em piscinas de aço inoxidável nas próprias usinas antes de ser, como os demais rejeitos, acondicionados em tambores que são dispostos em áreas cercadas ou encerrados em depósitos subterrâneos secos, como antigas minas de sal. A complexidade do problema do lixo atômico, comparativamente a outros lixos com substâncias tóxicas, se deve ao fato de
- a) emitir radiações nocivas, por milhares de anos, em um processo que não tem como ser interrompido artificialmente.
- b) acumular-se em quantidades bem maiores do que o lixo industrial convencional, faltando assim locais para reunir tanto material.
- c) ser constituído de materiais orgânicos que podem contaminar muitas espécies vivas, incluindo os próprios seres humanos.
- d) exalar continuamente gases venenosos, que tornariam o ar irrespirável por milhares de anos.
- e) emitir radiações e gases que podem destruir a camada de ozônio e agravar o efeito estufa.
- #206062
- Banca
- . Bancas Diversas
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
Chuva ácida é o termo utilizado para designar precipitações com valores de pH inferiores a 5,6. As principais substâncias que contribuem para esse processo são os óxidos de nitrogênio e de enxofre provenientes da queima de combustíveis fósseis e, também, de fontes naturais. Os problemas causados pela chuva ácida ultrapassam fronteiras políticas regionais e nacionais. A amplitude geográfica dos efeitos da chuva ácida está relacionada principalmente com
- a) a circulação atmosférica e a quantidade de fontes emissoras de óxidos de nitrogênio e de enxofre.
- b) a quantidade de fontes emissoras de óxidos de nitrogênio e de enxofre e a rede hidrográfica.
- c) a topografia do local das fontes emissoras de óxidos de nitrogênio e de enxofre e o nível dos lençóis freáticos.
- d) a quantidade de fontes emissoras de óxidos de nitrogênio e de enxofre e o nível dos lençóis freáticos.
- e) a rede hidrográfica e a circulação atmosférica.
- #206063
- Banca
- . Bancas Diversas
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
Para se obter 1,5 kg do dióxido de urânio puro, matéria- prima para a produção de combustível nuclear, é necessário extrair-se e tratar-se 1,0 tonelada de minério. Assim, o rendimento (dado em % em massa) do tratamento do minério até chegar ao dióxido de urânio puro é de
- a) 0,10%.
- b) 0,15%.
- c) 0,20%.
- d) 1,5%.
- e) 2,0%.
- #206066
- Banca
- . Bancas Diversas
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
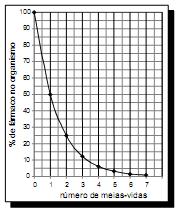
A duração do efeito de alguns fármacos está relacionada à sua meia- vida, tempo necessário para que a quantidade original do fármaco no organismo se reduza à metade. A cada intervalo de tempo correspondente a uma meia- vida, a quantidade de fármaco existente no organismo no final do intervalo é igual a 50% da quantidade no início desse intervalo.
O gráfico acima representa, de forma genérica, o que acontece com a quantidade de fármaco no organismo humano ao longo do tempo.
F. D. Fuchs e Cher l. Wannma. Farmacologia Clínica. Rio de Janeiro: Guanabara Koogan,1992, p. 40.
A meia-vida do antibiótico amoxicilina é de 1 hora. Assim, se uma dose desse antibiótico for injetada às 12 h em um paciente, o percentual dessa dose que restará em seu organismo às 13 h 30 min será aproximadamente de
- a) 10%.
- b) 15%.
- c) 25%.
- d) 35%.
- e) 50%.
- #206073
- Banca
- . Bancas Diversas
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
Os refrigerantes têm-se tornado cada vez mais o alvo de políticas públicas de saúde. Os de cola apresentam ácido fosfórico, substância prejudicial à fixação de cálcio, o mineral que é o principal componente da matriz dos dentes. A cárie é um processo dinâmico de desequilíbrio do processo de desmineralização dentária, perda de minerais em razão da acidez. Sabe- se que o principal componente do esmalte do dente é um sal denominado hidroxiapatita. O refrigerante, pela presença da sacarose, faz decrescer o pH do biofilme (placa bacteriana), provocando a desmineralização do esmalte dentário. Os mecanismos de defesa salivar levam de 20 a 30 minutos para normalizar o nível do pH, remineralizando o dente. A equação química seguinte representa esse processo:

Considerando que uma pessoa consuma refrigerantes diariamente, poderá ocorrer um processo de desmineralização dentária, devido ao aumento da concentração de
- a) OH_, que reage com os íons Ca 2+ , deslocando o equilíbrio para a direita.
- b) H+, que reage com as hidroxilas O H - , deslocando o equilíbrio para a direita.
- c) OH_, que reage com os íons Ca 2+ , deslocando o equilíbrio para a esquerda.
- d) H+, que reage com as hidroxilas OH - , deslocando o equilíbrio para a esquerda.
- e) Ca 2+ , que reage com as hidroxilas OH - , deslocando o equilíbrio para a esquerda.
- #206079
- Banca
- . Bancas Diversas
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
O peróxido de hidrogênio é comumente utilizado como antisséptico e alvejante. Também pode ser empregado em trabalhos de restauração de quadros enegrecidos e no clareamento de dentes. Na presença de soluções ácidas de oxidantes, como o permanganato de potássio, este óxido decompõe-se, conforme a equação a seguir:
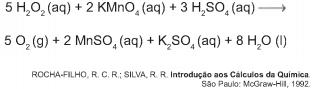
De acordo com a estequiometria da reação descrita, a quantidade de permanganato de potássio necessária para reagir completamente com 20,0 mL de uma solução 0,1 mol/L de peróxido de hidrogênio é igual a
- a) 2,0x10° mol.
- b) 2,0x10-3 mol.
- c) 8,0x10-1 mol.
- d) 8,0x10-4 mol.
- e) 5,0x10-3 mol.
- #206093
- Banca
- . Bancas Diversas
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
O rótulo de um desodorante aerossol informa ao consumidor que o produto possui em sua composição os gases isobutano, butano e propano, dentre outras substâncias. Além dessa informação, o rótulo traz, ainda, a inscrição “Não contém CFC”. As reações a seguir, que ocorrem na estratosfera, justificam a não utilização de CFC (clorofluorcarbono ou Freon) nesse desodorante:
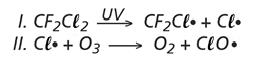
A preocupação com as possíveis ameaças à camada de ozônio (O3) baseia-se na sua principal função: proteger a matéria viva na Terra dos efeitos prejudiciais dos raios solares ultravioleta. A absorção da radiação ultravioleta pelo ozônio estratosférico é intensa o suficiente para eliminar boa parte da fração de ultravioleta que é prejudicial à vida.
A finalidade da utilização dos gases isobutano, butano e propano neste aerossol é
- a) substituir o CFC, pois não reagem com o ozônio, servindo como gases propelentes em aerossóis.
- b) servir como propelentes, pois, como são muito reativos, capturam o Freon existente livre na atmosfera, impedindo a destruição do ozônio.
- c) reagir com o ar, pois se decompõem espontaneamente em dióxido de carbono (CO2) e água (H2O), que não atacam o ozônio.
- d) impedir a destruição do ozônio pelo CFC, pois os hidrocarbonetos gasosos reagem com a radiação UV, liberando hidrogênio (H2), que reage com o oxigênio do ar (O2), formando água (H2O).
- e) destruir o CFC, pois reagem com a radiação UV, liberando carbono (C), que reage como oxigênio do ar (O2), formando dióxido de carbono (CO2), que é inofensivo para a camada de ozônio.
- #206102
- Banca
- . Bancas Diversas
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
Uma dona de casa acidentalmente deixou cair na geladeira a água proveniente do degelo de um peixe, o que deixou um cheiro forte e desagradável dentro do eletrodoméstico. Sabe-se que o odor característico de peixe se deve às aminas e que esses compostos se comportam como bases.
Na tabela são listadas as concentrações hidrogeniônicas de alguns materiais encontrados na cozinha, que a dona de casa pensa em utilizar na limpeza da geladeira.
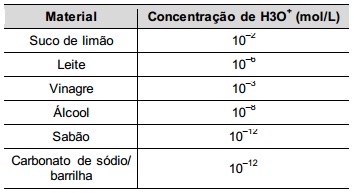
Dentre os materiais listados, quais são apropriados para amenizar esse odor?
- a) Álcool ou sabão.
- b) Suco de limão ou álcool.
- c) Suco de limão ou vinagre.
- d) Suco de limão, leite ou sabão.
- e) Sabão ou carbonato de sódio/barrilha.
- #206109
- Banca
- . Bancas Diversas
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
Em uma planície, ocorreu um acidente ambiental em decorrência do derramamento de grande quantidade de um hidrocarboneto que se apresenta na forma pastosa à temperatura ambiente. Um químico ambiental utilizou uma quantidade apropriada de uma solução de para-dodecil- benzenos sulfonato de sódio, um agente tenso ativo sintético, para diminuir os impactos desse acidente.
Essa intervenção produz resultados positivos para o ambiente porque
- a) promove uma reação de substituição no hidrocarboneto, tornando-o menos letal ao ambiente.
- b) a hidrólise do para-dodecil-benzenos sulfonato de sódio produz energia térmica-suficiente para vaporizar o hidrocarboneto.
- c) a mistura desses reagentes provoca a combustão do hidrocarboneto, o que diminui a quantidade dessa substância na natureza.
- d) a solução de para-dodecil-benzenos sulfonato possibilita a solubilização do hidrocarboneto.
- e) o reagente adicionado provoca uma solidificação do hidrocarboneto, o que facilita sua retirada do ambiente.

