Simulado ENEM | QUÍMICA | ENEM
SIMULADO ENEM | QUÍMICA
INSTRUÇÕES DESTE SIMULADO
OBJETIVOS DO SIMULADO
Aprimorar os conhecimentos adquiridos durante os seus estudos, de forma a avaliar a sua aprendizagem, utilizando para isso as metodologias e critérios idênticos aos maiores e melhores concursos públicos do País, através de simulado para ENEM, prova do ENEM e/ou questões do ENEM.
PÚBLICO ALVO DO SIMULADO
Alunos que almejam sua aprovação no ENEM. Que desejam tirar excelentes notas na prova do ENEM deste ano.
SOBRE AS QUESTÕES DO SIMULADO
Este simulado contém questões do ENEM e da banca INEP. Estas questões são especificamente para o Aluno ENEM , contendo QUÍMICA que foram extraídas de provas anteriores, portanto este simulado contém os gabaritos oficiais destas provas do ENEM.
ESTATÍSTICA DO SIMULADO
O simulado ENEM | QUÍMICA contém um total de 20 questões com um tempo estimado de 60 minutos para sua realização. O assunto abordado é diversificado para que você possa realmente simular como esta seus conhecimentos.
RANKING DO SIMULADO
Realize este simulado até o seu final e ao conclui-lo você verá as questões que errou e acertou, seus possíveis comentários e ainda poderá ver seu DESEMPENHO perante ao dos seus CONCORRENTES. Venha participar deste Ranking do ENEM e saia na frente de todos. Veja sua nota e sua colocação e saiba se esta preparado para conseguir sua aprovação.
Bons Estudos! Simulado para o ENEM é aqui!
- #89726
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
Após seu desgaste completo, os pneus podem ser queimados para a geração de energia. Dentre os gases gerados na combustão completa da borracha vulcanizada, alguns são poluentes e provocam a chuva ácida. Para evitar que escapem para a atmosfera, esses gases podem ser borbulhados em uma solução aquosa contendo uma substância adequada. Considere as informações das substâncias listadas no quadro.
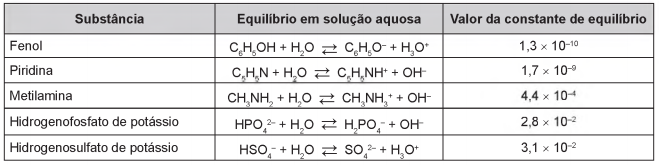
- a) fenol.
- b) piridina.
- c) metilamina.
- d) hidrogenofosfato de potássio.
- e) hidrogenosulfato de potássio.
- #89727
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
Para cada litro de etanol produzido em uma indústria de cana-de-açúcar são gerados cerca de 18 L de vinhaça que é utilizada na irrigação das plantações de cana-de-açúcar, já que contém teores médios de nutrientes N, P e K iguais a 357 mg/L, 60 mg/L e 2 034 mg/L, respectivamente.
SILVA, M. A. S.; GRIEBELER, N. P; BORGES, L. C. Uso de vinhaça e impactos nas propriedades do solo e lençol freático. Revista Brasileira de Engenharia Agrícola e Ambiental, n. 1, 2007 (adaptado).
Na produção de 27 000 L de etanol, a quantidade total de fósforo, em kg, disponível na vinhaça será mais próxima de
- a) 1.
- b) 29.
- c) 60.
- d) 170.
- e) 1 000.
- #89728
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
O carvão ativado é um material que possui elevado teor de carbono, sendo muito utilizado para a remoção de compostos orgânicos voláteis do meio, como o benzeno. Para a remoção desses compostos, utiliza-se a adsorção. Esse fenômeno ocorre por meio de interações do tipo intermoleculares entre a superfície do carvão (adsorvente) e o benzeno (adsorvato, substância adsorvida).
No caso apresentado, entre o adsorvente e a substância adsorvida ocorre a formação de:
- a) Ligações dissulfeto.
- b) Ligações covalentes.
- c) Ligações de hidrogênio.
- d) Interações dipolo induzido - dipolo induzido.
- e) Interações dipolo permanente - dipolo permanente.
- #89729
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
A minimização do tempo e custo de uma reação química, bem como o aumento na sua taxa de conversão, caracterizam a eficiência de um processo químico. Como consequência, produtos podem chegar ao consumidor mais baratos. Um dos parâmetros que mede a eficiência de uma reação química é o seu rendimento molar (R, em %), definido como
![]()
em que n corresponde ao número de mols. O metanol pode ser obtido pela reação entre brometo de metila e hidróxido de sódio, conforme a equação química:
CH3Br + NaOH ? CH3OH + NaBr
As massas molares (em g/mol) desses elementos são: H = 1; C = 12; O = 16; Na = 23; Br = 80.
O rendimento molar da reação, em que 32 g de metanol foram obtidos a partir de 142,5 g de brometo de metila e 80 g de hidróxido de sódio, é mais próximo de
- a) 22%.
- b) 40%.
- c) 50%.
- d) 67%.
- e) 75%.
- #89730
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
O esquema representa, de maneira simplificada, o processo de produção de etanol utilizando milho como matéria-prima.
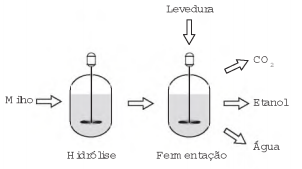
- a) a glicose seja convertida em sacarose.
- b) as enzimas dessa planta sejam ativadas.
- c) a maceração favoreça a solubilização em água.
- d) o amido seja transformado em substratos utilizáveis pela levedura.
- e) os grãos com diferentes composições químicas sejam padronizados.
- #89731
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
Os feromônios são substâncias utilizadas na comunicação entre indivíduos de uma espécie. O primeiro feromônio isolado de um inseto foi o bombicol, substância produzida pela mariposa do bicho-da-seda.

O uso de feromônios em ações de controle de insetos-praga está de acordo com o modelo preconizado para a agricultura do futuro. São agentes altamente específicos e seus compostos químicos podem ser empregados em determinados cultivos, conforme ilustrado no quadro.
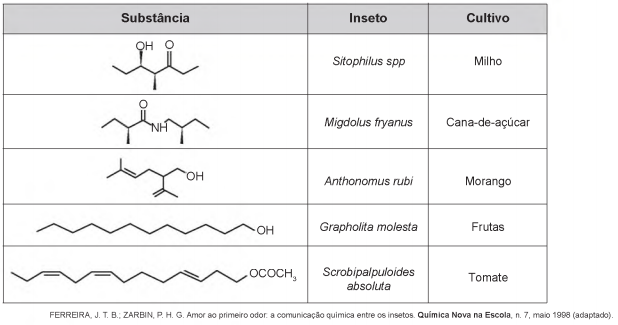
- a) Sitophilus spp.
- b) Migdolus fryanus.
- c) Anthonomus rubi.
- d) Grapholita molesta.
- e) Scrobipalpuloides absoluta.
- #89732
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
Em meados de 2003, mais de 20 pessoas morreram no Brasil após terem ingerido uma suspensão de sulfato de bário utilizada como contraste em exames radiológicos. O sulfato de bário é um sólido pouquíssimo solúvel em água, que não se dissolve mesmo na presença de ácidos. As mortes ocorreram porque um laboratório farmacêutico forneceu o produto contaminado com carbonato de bário, que é solúvel em meio ácido. Um simples teste para verificar a existência de íons bário solúveis poderia ter evitado a tragédia. Esse teste consiste em tratar a amostra com solução aquosa de HCI e, após filtrar para separar os compostos insolúveis de bário, adiciona-se solução aquosa de H2SO4 sobre o filtrado e observa-se por 30 min.
TUBINO, M.; SIMONI, J. A. Refletindo sobre o caso Celobar®. Química Nova, n. 2, 2007 (adaptado).
A presença de íons bário solúveis na amostra é indicada pela
- a) liberação de calor.
- b) alteração da cor para rosa.
- c) precipitação de um sólido branco.
- d) formação de gás hidrogênio.
- e) volatilização de gás cloro.
- #89733
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
Em sua formulação, o spray de pimenta contém porcentagens variadas de oleorresina de Capsicum, cujo princípio ativo é a capsaicina, e um solvente (um álcool como etanol ou isopropanol). Em contato com os olhos, pele ou vias respiratórias, a capsaicina causa um efeito inflamatório que gera uma sensação de dor e ardor, levando à cegueira temporária. O processo é desencadeado pela liberação de neuropeptídios das terminações nervosas.
Como funciona o gás de pimenta. Disponível em: http://pessoas.hsw.uol.com.br. Acesso em: 1 mar. 2012 (adaptado).
Quando uma pessoa é atingida com o spray de pimenta nos olhos ou na pele, a lavagem da região atingida com água é ineficaz porque a
- a) reação entre etanol e água libera calor, intensificando o ardor.
- b) solubilidade do princípio ativo em água é muito baixa, dificultando a sua remoção.
- c) permeabilidade da água na pele é muito alta, não permitindo a remoção do princípio ativo.
- d) solubilização do óleo em água causa um maior espalhamento além das áreas atingidas.
- e) ardência faz evaporar rapidamente a água, não permitindo que haja contato entre o óleo e o solvente.
- #89734
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
O álcool utilizado como combustível automotivo (etanol hidratado) deve apresentar uma taxa máxima de água em sua composição para não prejudicar o funcionamento do motor. Uma maneira simples e rápida de estimar a quantidade de etanol em mistura com água é medir a densidade da mistura. O gráfico mostra a vaiação da densidade da mistura (água e etanol) com a fração percentual da massa de etanol (fe ), dada pela expressão
]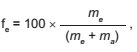
em que me e ma são as massas de etanol e de água na mistura, respectivamente, a uma temperatura de 20 °C.
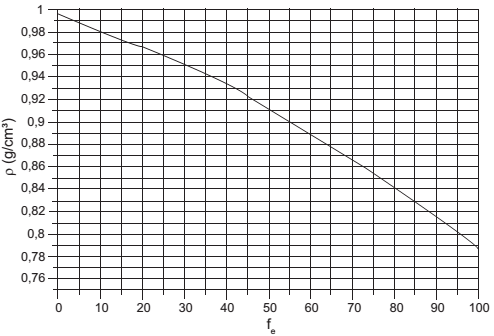
Disponível em: www.handymath.com. Acesso em: 8 ago. 2012.
Suponha que em uma inspeção de rotina realizada em determinado posto, tenha-se verificado que 50,0 cm3 de álcool combustível tenham massa igual a 45,0 g. Qual é a fração percentual de etanol nessa mistura?
- a) 7%
- b) 10%
- c) 55%
- d) 90%
- e) 93%
- #89735
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
O vinagre vem sendo usado desde a Antiguidade como conservante de alimentos, bem como agente de limpeza e condimento. Um dos principais componentes do vinagre é o ácido acético (massa molar 60 g/mol), cuja faixa de concentração deve se situar entre 4% a 6% (m/v). Em um teste de controle de qualidade foram analisadas cinco marcas de diferentes vinagres, e as concentrações de ácido acético, em mol/L, se encontram no quadro.
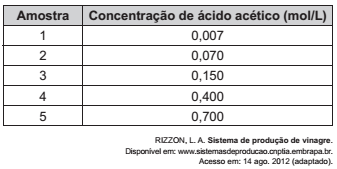
A amostra de vinagre que se encontra dentro do limite de concentração tolerado é a
- a) 1.
- b) 2.
- c) 3.
- d) 4.
- e) 5.
- #89736
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
O Nylon® é um polímero (uma poliamida) obtido pela reação do ácido adípico com a hexametilenodiamina, como indicado no esquema reacional.
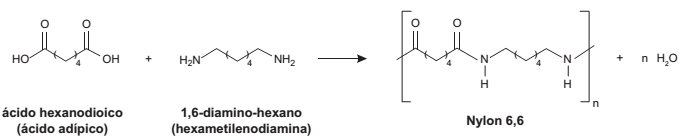
Na época da invenção desse composto, foi proposta uma nomenclatura comercial, baseada no número de átomos de carbono do diácido carboxílico, seguido do número de carbonos da diamina.
De acordo com as informações do texto, o nome comercial de uma poliamida resultante da reação do ácido butanodioico com o 1,2-diamino-etano é
- a) Nylon 4,3.
- b) Nylon 6,2.
- c) Nylon 3,4.
- d) Nylon 4,2.
- e) Nylon 2,6.
- #89737
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
O quadro apresenta a composição do petróleo.
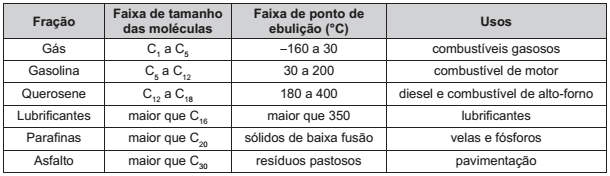
BROWN, T. L. et al. Química: a ciência central. São Paulo: Person Prentice Hall, 2005.
Para a separação dos constituintes com o objetivo de produzir a gasolina, o método a ser utilizado é a
- a) filtração.
- b) destilação.
- c) decantação.
- d) precipitação.
- e) centrifugação.
- #89738
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
O poli(ácido lático) ou PLA é um material de interesse tecnológico por ser um polímero biodegradável e bioabsorvível. O ácido lático, um metabólito comum no organismo humano, é a matéria-prima para produção do PLA, de acordo com a equação química simplificada:
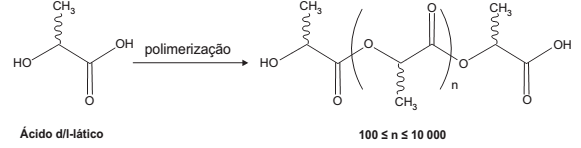
Que tipo de polímero de condensação é formado nessa reação?
- a) Poliéster.
- b) Polivinila.
- c) Poliamida.
- d) Poliuretana.
- e) Policarbonato.
- #89739
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
Uma enzima foi retirada de um dos órgãos do sistema digestório de um cachorro e, após ser purificada, foi diluída em solução fisiológica e distribuída em três tubos de ensaio com os seguintes conteúdos:
• Tubo 1: carne
• Tubo 2: macarrão
• Tubo 3: banha
Em todos os tubos foi adicionado ácido clorídrico (HCl), e o pH da solução baixou para um valor próximo a 2. Além disso, os tubos foram mantidos por duas horas a uma temperatura de 37 °C. A digestão do alimento ocorreu somente no tubo 1.
De qual órgão do cachorro a enzima foi retirada?
- a) Fígado.
- b) Pâncreas.
- c) Estômago.
- d) Vesícula biliar.
- e) Intestino delgado.
- #89740
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
Os calcários são materiais compostos por carbonato de cálcio, que podem atuar como sorventes do dióxido de enxofre (SO2 ), um importante poluente atmosférico. As reações envolvidas no processo são a ativação do calcário, por meio de calcinação, e a fixação do SO2 com a formação de um sal de cálcio, como ilustrado pelas equações químicas simplificadas.
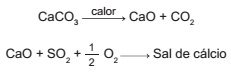
Considerando-se as reações envolvidas nesse processo de dessulfurização, a fórmula química do sal de cálcio corresponde a
- a) CaSO3 .
- b) CaSO4.
- c) CaS2O8 .
- d) CaSO2 .
- e) CaS2O7 .

