Simulado ENEM | QUÍMICA | ENEM
SIMULADO ENEM | QUÍMICA
INSTRUÇÕES DESTE SIMULADO
OBJETIVOS DO SIMULADO
Aprimorar os conhecimentos adquiridos durante os seus estudos, de forma a avaliar a sua aprendizagem, utilizando para isso as metodologias e critérios idênticos aos maiores e melhores concursos públicos do País, através de simulado para ENEM, prova do ENEM e/ou questões do ENEM.
PÚBLICO ALVO DO SIMULADO
Alunos que almejam sua aprovação no ENEM. Que desejam tirar excelentes notas na prova do ENEM deste ano.
SOBRE AS QUESTÕES DO SIMULADO
Este simulado contém questões do ENEM e da banca INEP. Estas questões são especificamente para o Aluno ENEM , contendo QUÍMICA que foram extraídas de provas anteriores, portanto este simulado contém os gabaritos oficiais destas provas do ENEM.
ESTATÍSTICA DO SIMULADO
O simulado ENEM | QUÍMICA contém um total de 20 questões com um tempo estimado de 60 minutos para sua realização. O assunto abordado é diversificado para que você possa realmente simular como esta seus conhecimentos.
RANKING DO SIMULADO
Realize este simulado até o seu final e ao conclui-lo você verá as questões que errou e acertou, seus possíveis comentários e ainda poderá ver seu DESEMPENHO perante ao dos seus CONCORRENTES. Venha participar deste Ranking do ENEM e saia na frente de todos. Veja sua nota e sua colocação e saiba se esta preparado para conseguir sua aprovação.
Bons Estudos! Simulado para o ENEM é aqui!
- #89410
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
A escolha de uma determinada substância para ser utilizada como combustível passa pela análise da poluição que ela causa ao ambiente e pela quantidade de energia liberada em sua combustão completa. O quadro apresenta a entalpia de combustão de algumas substâncias. As massas molares dos elementos H, C e O são, respectivamente, iguais a 1 g/mol, 12 g/mol e 16 g/mol.
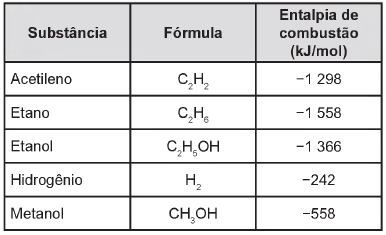
Levando-se em conta somente o aspecto energético, a substância mais eficiente para a obtenção de energia, na combustão de 1 kg de combustível, é o
- a) etano.
- b) etanol.
- c) metanol.
- d) acetileno.
- e) hidrogênio.
- #89411
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
A formação de estalactites depende da reversibilidade de uma reação química. O carbonato de cálcio (CaCO3) é encontrado em depósitos subterrâneos na forma de pedra calcária. Quando um volume de água rica em C 02 dissolvido infiltra-se no calcário, o minério dissolve-se formando íons Ca2+ e HCO3-. Numa segunda etapa, a solução aquosa desses íons chega a uma caverna e ocorre a reação inversa, promovendo a liberação de CO2 e a deposição de CaCO3, de acordo com a equação apresentada.
![]()
KOTZ, J. C.; TREICHEL, P L.; WEAVER, G. C. Química geral e reações químicas. São Paulo: Cengage Learning, 2010 (adaptado).
Considerando o equilíbrio que ocorre na segunda etapa, a formação de carbonato será favorecida pelo(a)
- a) diminuição da concentração de íons OH" no meio.
- b) aumento da pressão do ar no interior da caverna.
- c) diminuição da concentração de HCO3- no meio.
- d) aumento da temperatura no interior da caverna.
- e) aumento da concentração de CO2 dissolvido.
- #89412
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
O bisfenol-A é um composto que serve de matéria-prima para a fabricação de polímeros utilizados em embalagens plásticas de alimentos, em mamadeiras e no revestimento interno de latas. Esse composto está sendo banido em diversos países, incluindo o Brasil, principalmente por ser um mimetizador de estrógenos (hormônios) que, atuando como tal no organismo, pode causar infertilidade na vida adulta. O bisfenol-A (massa molar igual a 228 g/mol) é preparado pela condensação da propanona (massa molar igual a 58 g/mol) com fenol (massa molar igual a 94 g/mol), em meio ácido, conforme apresentado na equação química.
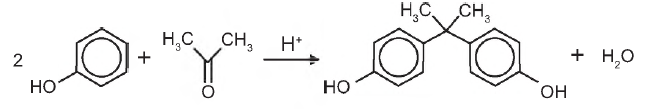
PASTORE, M. Anvisa proíbe mamadeiras com bisfenol-A no Brasil. Folha de S. Paulo, 15 set. 2011 (adaptado).
Considerando que, ao reagir 580 g de propanona com 3 760 g de fenol, obteve-se 1,14 kg de bisfenol-A, de acordo com a reação descrita, o rendimento real do processo foi de
- a) 0,025%.
- b) 0,05%.
- c) 12,5%.
- d) 25%.
- e) 50%.
- #89413
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
A tabela lista os valores de pH de algumas bebidas consumidas pela população.

O esmalte dos dentes é constituído de hidroxiapatita (Ca5(PO4)3OH), um mineral que sofre desmineralização em meio ácido, de acordo com a equação química:
Ca5(PO4)3OH (s)  5 Ca2+ (aq) + 3 PO43- (aq) + OH- (aq)
5 Ca2+ (aq) + 3 PO43- (aq) + OH- (aq)
Das bebidas listadas na tabela, aquela com menor potencial de desmineralização dos dentes é o
- a) chá.
- b) café.
- c) vinho.
- d) refrigerante.
- e) suco de limão.
- #89414
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
No Brasil e no mundo têm surgido movimentos e leis para banir o uso de sacolas plásticas, em supermercados, feitas de polietileno. Obtida a partir do petróleo, a matéria-prima do polietileno é o gás etileno, que depois de polimerizado dá origem ao plástico, composto essencialmente formado pela repetição de grupos —CH2—. O principal motivo do banimento é a poluição, pois se estima que as sacolas levam cerca de 300 anos para se degradarem no meio ambiente, sendo resistentes a ataques químicos, à radiação e a microrganismos.
O motivo pelo qual essas sacolas demoram muito tempo para se degradarem é que suas moléculas
- a) apresentam muitas insaturações.
- b) contêm carbono em sua composição.
- c) são formadas por elementos de alta massa atômica.
- d) são muito longas e formadas por ligações químicas fortes.
- e) têm origem no petróleo, que é uma matéria-prima não renovável.
- #89415
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
Um método para determinação do teor de etanol na gasolina consiste em misturar volumes conhecidos de água e de gasolina em um frasco específico. Após agitar o frasco e aguardar um período de tempo, medem-se os volumes das duas fases imiscíveis que são obtidas: uma orgânica e outra aquosa. O etanol, antes miscível com a gasolina, encontra-se agora miscível com a água.
Para explicar o comportamento do etanol antes e depois da adição de água, é necessário conhecer
- a) a densidade dos líquidos.
- b) o tamanho das moléculas.
- c) o ponto de ebulição dos líquidos.
- d) os átomos presentes nas moléculas.
- e) o tipo de interação entre as moléculas.
- #89416
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
A liberação dos gases clorofluorcarbonos (CFCs) na atmosfera pode provocar depleção de ozônio (O3) na estratosfera. O ozônio estratosférico é responsável por absorver parte da radiação ultravioleta emitida pelo Sol, a qual é nociva aos seres vivos. Esse processo, na camada de ozônio, é ilustrado simplificadamente na figura.
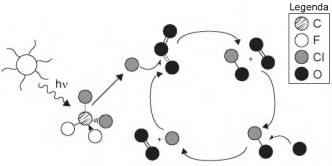
Quimicamente, a destruição do ozônio na atmosfera por gases CFCs é decorrência da
- a) clivagem da molécula de ozônio pelos CFCs para produzir espécies radicalares.
- b) produção de oxigênio molecular a partir de ozônio, catalisada por átomos de cloro.
- c) oxidação do monóxido de cloro por átomos de oxigênio para produzir átomos de cloro.
- d) reação direta entre os CFCs e o ozônio para produzir oxigênio molecular e monóxido de cloro.
- e) reação de substituição de um dos átomos de oxigênio na molécula de ozônio por átomos de cloro
- #89417
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
O Instituto Luiz Coimbra (UFRJ) lançou o primeiro ônibus urbano movido a hidrogênio do Hemisfério Sul, com tecnologia inteiramente nacional. Sua tração provém de três fontes de energia, sendo uma delas a pilha de combustível, na qual o hidrogênio, gerado por um processo eletroquímico, reage com o oxigênio do ar, formando água.
FRAGA, I. Disponível em: http://cienciahoje.uol.com.br. Acesso em: 20 jul. 2010 (adaptado).
A transformação de energia que ocorre na pilha de combustível responsável pelo movimento do ônibus decorre da energia cinética oriunda do(a)
- a) calor absorvido na produção de água.
- b) expansão gasosa causada pela produção de água.
- c) calor liberado pela reação entre o hidrogênio e o oxigênio.
- d) contração gasosa causada pela reação entre o hidrogênio e o oxigênio.
- e) eletricidade gerada pela reação de oxirredução do hidrogênio com o oxigênio.
- #89418
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
A hematita (?-Fe2O3), além de ser utilizada para obtenção do aço, também é utilizada como um catalisador de processos químicos, como na síntese da amônia, importante matéria-prima da indústria agroquímica.
MEDEIROS, M. A. F Química Nova na Escola, São Paulo, v. 32, n. 3, ago. 2010 (adaptado).
O uso da hematita viabiliza economicamente a produção da amônia, porque
- a) diminui a rapidez da reação.
- b) diminui a energia de ativação da reação.
- c) aumenta a variação da entalpia da reação.
- d) aumenta a quantidade de produtos formados.
- e) aumenta o tempo do processamento da reação.
- #89419
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
O mármore é um material empregado para revestimento de pisos e um de seus principais constituintes é o carbonato de cálcio. Na limpeza desses pisos com solução ácida, ocorre efervescência.
Nessa efervescência o gás liberado é o
- a) oxigênio.
- b) hidrogênio.
- c) cloro.
- d) dióxido de carbono.
- e) monóxido de carbono.
- #89420
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
Há processos industriais que envolvem reações químicas na obtenção de diversos produtos ou bens consumidos pelo homem. Determinadas etapas de obtenção desses produtos empregam catalisadores químicos tradicionais, que têm sido, na medida do possível, substituídos por enzimas.
Em processos industriais, uma das vantagens de se substituírem os catalisadores químicos tradicionais por enzimas decorre do fato de estas serem
- a) consumidas durante o processo.
- b) compostos orgânicos e biodegradáveis.
- c) inespecíficas para os substratos.
- d) estáveis em variações de temperatura.
- e) substratos nas reações químicas.
- #89421
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
Os densímetros instalados nas bombas de combustível permitem averiguar se a quantidade de água presente no álcool hidratado está dentro das especificações determinadas pela Agência Nacional do Petróleo (ANP). O volume máximo permitido de água no álcool é de 4,9%. A densidade da água e do álcool anidro são de 1,00 g/cm3 e 0,80 g/cm3, respectivamente.
Disponível em: http://nxt.anp.gov.br. Acesso em: 5 dez. 2011 (adaptado).
A leitura no densímetro que corres ponde ri a à fração máxima permitida de água é mais próxima de
- a) 0,20 g/cm3.
- b) 0,81 g/cm3.
- c) 0,90 g/cm3.
- d) 0,99 g/cm3.
- e) 1,80 g/cm3.
- #89422
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
Para a produção de etanol combustível, as usinas retiram água do leito de rios próximos, reutilizando-a nas suas instalações. A vinhaça, resíduo líquido gerado nesse processo, é diluída para ser adicionada ao solo, utilizando uma técnica chamada de fertirrigação. Por meio desse procedimento, o fósforo e o potássio, essenciais à produção de cana-de-açúcar, são devolvidos ao solo, reduzindo o uso de fertilizantes sintéticos.
Essa intervenção humana no destino da vinhaça tem como resultado a diminuição do impacto ambiental referente à
- a) erosão do solo.
- b) produção de chuva ácida.
- c) elevação da temperatura global.
- d) eutrofização de lagos e represas.
- e) contaminação de rios por pesticidas.
- #89423
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
Se dermos uma mordida em um pedaço de papel alumínio colocado em cima de uma obturação de amálgama (combinação do mercúrio metálico com metais e/ou ligas metálicas), sentiremos uma dor causada por uma corrente que pode chegar até 30 ?A.
SILVA, R. R. et al. Química Nova na Escola, São Paulo, n. 13, maio 2001 (adaptado).
O contato dos materiais metálicos citados produz
- a) uma pilha, cujo fluxo de elétrons é espontâneo.
- b) uma eletrólise, cujo fluxo de elétrons não é espontâneo.
- c) uma solução eletrolítica, cujo fluxo de elétrons é espontâneo.
- d) um sistema galvânico, cujo fluxo de elétrons não é espontâneo.
- e) um sistema eletrolítico, cujo fluxo de elétrons não é espontâneo.
- #89424
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
Após o desmonte da bateria automotiva, é obtida uma pasta residual de 6 kg, em que 19%, em massa, é dióxido de chumbo(IV), 60%, sulfato de chumbo(N) e 21%, chumbo metálico. O processo pirometalúrgico é o mais comum na obtenção do chumbo metálico, porém, devido à alta concentração de sulfato de chumbo(II), ocorre grande produção de dióxido de enxofre (SO2), causador de problemas ambientais. Para eliminar a produção de dióxido de enxofre, utiliza-se o processo hidrometalúrgico, constituído de três etapas, no qual o sulfato de chumbo(II) reage com carbonato de sódio a 1,0 mol/L a 45 °C, obtendo-se um sal insolúvel (etapa 1), que, tratado com ácido nítrico, produz um sal de chumbo solúvel (etapa 2) e, por eletrólise, obtém-se o chumbo metálico com alto grau de pureza (etapa 3).
ARAÚJO, R. V. V et al. Reciclagem de chumbo de bateria automotiva: estudo de caso. Disponível em: www.iqsc.usp.br. Acesso em: 17 abr. 2010 (adaptado).
Considerando a obtenção de chumbo metálico a partir de sulfato de chumbo(II) na pasta residual, pelo processo hidrometalúrgico, as etapas 1, 2 e 3 objetivam, respectivamente,
- a) a lixiviação básica e dessulfuração; a lixiviação ácida e solubilização; a redução do Pb2+ em Pb0.
- b) a lixiviação ácida e dessulfuração; a lixiviação básica e solubilização; a redução do Pb4+ em Pb0.
- c) a lixiviação básica e dessulfuração; a lixiviação ácida e solubilização; a redução do Pb0 em Pb2+
- d) a lixiviação ácida e dessulfuração; a lixiviação básica e solubilização; a redução do Pb2+ em Pb0.
- e) a lixiviação básica e dessulfuração; a lixiviação ácida e solubilização; a redução do Pb4+ em Pb0.

