Simulado ENEM | QUÍMICA | ENEM
SIMULADO ENEM | QUÍMICA
INSTRUÇÕES DESTE SIMULADO
OBJETIVOS DO SIMULADO
Aprimorar os conhecimentos adquiridos durante os seus estudos, de forma a avaliar a sua aprendizagem, utilizando para isso as metodologias e critérios idênticos aos maiores e melhores concursos públicos do País, através de simulado para ENEM, prova do ENEM e/ou questões do ENEM.
PÚBLICO ALVO DO SIMULADO
Alunos que almejam sua aprovação no ENEM. Que desejam tirar excelentes notas na prova do ENEM deste ano.
SOBRE AS QUESTÕES DO SIMULADO
Este simulado contém questões do ENEM e da banca INEP. Estas questões são especificamente para o Aluno ENEM , contendo QUÍMICA que foram extraídas de provas anteriores, portanto este simulado contém os gabaritos oficiais destas provas do ENEM.
ESTATÍSTICA DO SIMULADO
O simulado ENEM | QUÍMICA contém um total de 20 questões com um tempo estimado de 60 minutos para sua realização. O assunto abordado é diversificado para que você possa realmente simular como esta seus conhecimentos.
RANKING DO SIMULADO
Realize este simulado até o seu final e ao conclui-lo você verá as questões que errou e acertou, seus possíveis comentários e ainda poderá ver seu DESEMPENHO perante ao dos seus CONCORRENTES. Venha participar deste Ranking do ENEM e saia na frente de todos. Veja sua nota e sua colocação e saiba se esta preparado para conseguir sua aprovação.
Bons Estudos! Simulado para o ENEM é aqui!
- #89390
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
Nos anos 1990, verificou-se que o rio Potomac, situado no estado norte-americano de Maryland, tinha, em parte de seu curso, águas extremamente ácidas por receber um efluente de uma mina de carvão desativada, o qual continha ácido sulfúrico (H2SO4). Essa água, embora límpida, era desprovida de vida. Alguns quilômetros adiante, instalou-se uma fábrica de papel e celulose que emprega hidróxido de sódio (NaOH) e carbonato de sódio (Na2CO3) em seus processos. Em pouco tempo, observou-se que, a partir do ponto em que a fábrica lança seus rejeitos no rio, a vida aquática voltou a florescer.
HARRIS, D. C. Análise química quantitativa. Rio de Janeiro: Livros Técnicos e Científicos, 2012 (adaptado).
A explicação para o retorno da vida aquática nesse rio é a
- a) diluição das águas do rio pelo novo efluente lançado nele.
- b) precipitação do íon sulfato na presença do efluente da nova fábrica.
- c) biodegradação do ácido sulfúrico em contato com o novo efluente descartado.
- d) diminuição da acidez das águas do rio pelo efluente da fábrica de papel e celulose.
- e) volatilização do ácido sulfúrico após contato com o novo efluente introduzido no rio.
- #89391
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
O soro fisiológico é uma solução aquosa de cloreto de sódio (NaCl) comumente utilizada para higienização ocular, nasal, de ferimentos e de lentes de contato. Sua concentração é 0,90% em massa e densidade igual a 1,00 g/mL.
Qual massa de NaCl, em grama, deverá ser adicionada à água para preparar 500 mL desse soro?
- a) 0,45
- b) 0,90
- c) 4,50
- d) 9,00
- e) 45,00
- #89392
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
Algumas práticas agrícolas fazem uso de queimadas, apesar de produzirem grandes efeitos negativos. Por exemplo, quando ocorre a queima da palha de cana-de-açúcar, utilizada na produção de etanol, há emissão de poluentes como CO2, SOx, NOx e materiais particulados (MP) para a atmosfera. Assim, a produção de biocombustíveis pode, muitas vezes, ser acompanhada da emissão de vários poluentes.
CARDOSO, A. A.; MACHADO, C. M. D.; PEREIRA, E. A. Biocombustível: o mito do combustível limpo. Química Nova na Escola, n. 28, maio 2008 (adaptado).
Considerando a obtenção e o consumo desse biocombustível, há transformação química quando
- a) o etanol é armazenado em tanques de aço inoxidável.
- b) a palha de cana-de-açúcar é exposta ao sol para secagem.
- c) a palha da cana e o etanol são usados como fonte de energia.
- d) os poluentes SOx, NOx e MP são mantidos intactos e dispersos na atmosfera.
- e) os materiais particulados (MP) são espalhados no ar e sofrem deposição seca.
- #89393
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
Os métodos empregados nas análises químicas são ferramentas importantes para se conhecer a composição dos diversos materiais presentes no meio ambiente. É comum, na análise de metais presentes em amostras ambientais, como água de rio ou de mar, a adição de um ácido mineral forte, normalmente o ácido nítrico (HNO3), com a finalidade de impedir a precipitação de compostos pouco solúveis desses metais ao longo do tempo.
Na ocorrência de precipitação, o resultado da análise pode ser subestimado, porque
- a) ocorreu passagem de parte dos metais para uma fase sólida.
- b) houve volatilização de compostos dos metais para a atmosfera.
- c) os metais passaram a apresentar comportamento de não metais.
- d) formou-se uma nova fase líquida, imiscível com a solução original.
- e) os metais reagiram com as paredes do recipiente que contém a amostra.
- #89394
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
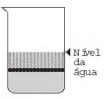
Os tensoativos são compostos capazes de interagir com substâncias polares e apolares. A parte iônica dos tensoativos interage com substâncias polares, e a parte lipofílica interage com as apolares. A estrutura orgânica de um tensoativo pode ser representada por:
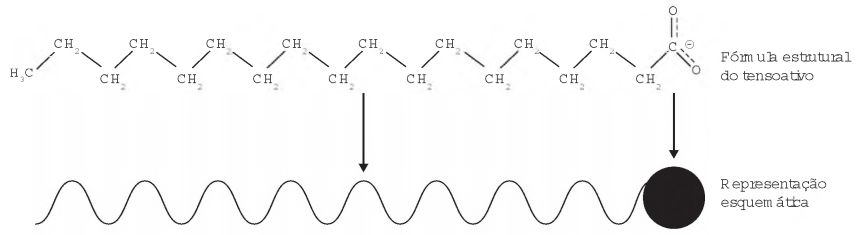
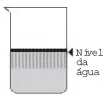
Ao adicionar um tensoativo sobre a água, suas moléculas formam um arranjo ordenado.
Esse arranjo é representado esquematicamente por:
- a)
- b)
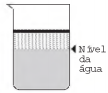
- c)
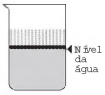
- d)

- e)
- #89395
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
A lipofilia é um dos fatores fundamentais para o planejamento de um fármaco. Ela mede o grau de afinidade que a substância tem com ambientes apolares, podendo ser avaliada por seu coeficiente de partição.
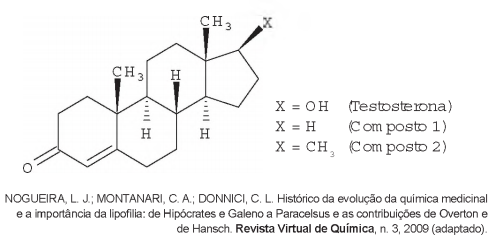
Em relação ao coeficiente de partição da testosterona, as lipofilias dos compostos 1 e 2 são, respectivamente,
- a) menor e menor que a lipofilia da testosterona.
- b) menor e maior que a lipofilia da testosterona.
- c) maior e menor que a lipofilia da testosterona.
- d) maior e maior que a lipofilia da testosterona.
- e) menor e igual à lipofilia da testosterona.
- #89396
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
O urânio é um elemento cujos átomos contêm 92 prótons, 92 elétrons e entre 135 e 148 nêutrons. O isótopo de urânio 235U é utilizado como combustível em usinas nucleares, onde, ao ser bombardeado por nêutrons, sofre fissão de seu núcleo e libera uma grande quantidade de energia (2,35 x1010 kJ/mol). O isótopo 235U ocorre naturalmente em minérios de urânio, com concentração de apenas 0,7%. Para ser utilizado na geração de energia nuclear, o minério é submetido a um processo de enriquecimento, visando aumentar a concentração do isótopo 235U para, aproximadamente, 3% nas pastilhas. Em décadas anteriores, houve um movimento mundial para aumentar a geração de energia nuclear buscando substituir, parcialmente, a geração de energia elétrica a partir da queima do carvão, o que diminui a emissão atmosférica de CO2 (gás com massa molar igual a 44 g/mol). A queima do carvão é representada pela equação química:
C(s) + O2 (g) ? CO2(g) ?H = -400 kJ/mol
Qual é a massa de CO2 , em toneladas, que deixa de ser liberada na atmosfera, para cada 100 g de pastilhas de urânio enriquecido utilizadas em substituição ao carvão como fonte de energia?
- a) 2,10
- b) 7,70
- c) 9,00
- d) 33,0
- e) 300
- #89397
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
A calda bordalesa é uma alternativa empregada no combate a doenças que afetam folhas de plantas. Sua produção consiste na mistura de uma solução aquosa de sulfato de cobre(II), CuSO4, com óxido de cálcio, CaO, e sua aplicação só deve ser realizada se estiver levemente básica. A avaliação rudimentar da basicidade dessa solução é realizada pela adição de três gotas sobre uma faca de ferro limpa. Após três minutos, caso surja uma mancha avermelhada no local da aplicação, afirma-se que a calda bordalesa ainda não está com a basicidade necessária. O quadro apresenta os valores de potenciais padrão de redução (E°) para algumas semirreações de redução.

A equação química que representa a reação de formação da mancha avermelhada é:
- a) Ca2+ (aq) + 2 Cu+ (aq) → Ca (s) + 2 Cu2+ (aq).
- b) Ca2+ (aq) + 2 Fe2+ (aq) → Ca (s) + 2 Fe3+ (aq).
- c) Cu2+ (aq) + 2 Fe2+ (aq) → Cu (s) + 2 Fe3+ (aq).
- d) 3 Ca2+ (aq) + 2 Fe (s) → 3 Ca (s) + 2 Fe3+ (aq).
- e) 3 Cu2+ (aq) + 2 Fe (s) → 3 Cu (s) + 2 Fe3+ (aq).
- #89398
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
Hidrocarbonetos podem ser obtidos em laboratório por descarboxilação oxidativa anódica, processo conhecido como eletrossíntese de Kolbe. Essa reação é utilizada na síntese de hidrocarbonetos diversos, a partir de óleos vegetais, os quais podem ser empregados como fontes alternativas de energia, em substituição aos hidrocarbonetos fósseis. O esquema ilustra simplificadamente esse processo.
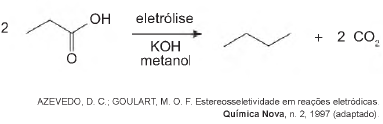
Com base nesse processo, o hidrocarboneto produzido na eletrólise do ácido 3,3-dimetil-butanoico é
- a) 2,2,7,7-tetrametil-octano.
- b) 3,3,4,4-tetrametil-hexano.
- c) 2,2,5,5-tetrametil-hexano.
- d) 3,3,6,6-tetrametil-octano.
- e) 2,2,4,4-tetrametil-hexano.
- #89399
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
Para proteger estruturas de aço da corrosão, a indústria utiliza uma técnica chamada galvanização. Um metal bastante utilizado nesse processo é o zinco,que pode ser obtido a partir de um minério denominado esfalerita (ZnS), de pureza 75%. Considere que a conversão do minério em zinco metálico tem rendimento de 80% nesta sequência de equações químicas:
2 ZnS + 3 O2 ? 2 ZnO + 2 S02
ZnO + CO ? Z n + C02
Considere as massas molares: ZnS (97 g/mol); O2 (32 g/mol);ZnO (81 g/mol); SO2 (64 g/mol); CO (28 g/mol); CO2 (44 g/mol); e Zn (65 g/mol).
Que valor mais próximo de massa de zinco metálico,em quilogramas, será produzido a partir de 100 kg de esfalerita?
- a) 25
- b) 33
- c) 40
- d) 50
- e) 54
- #89400
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
"A bomba reduz neutros e neutrinos, e abana-se com o leque da reação em cadeia"
ANDRADE, C. D. Poesia completa e prosa. Rio de Janeiro: Aguilar, 1973 (fragmento).
Nesse fragmento de poema, o autor refere-se à bomba atômica de urânio. Essa reação é dita “em cadeia" porque na
- a) fissão do 235U ocorre liberação de grande quantidade de calor, que dá continuidade à reação.
- b) fissão de 235U ocorre liberação de energia, que vai desintegrando o isótopo 238U, enriquecendo-o em mais 235U
- c) fissão do 235U ocorre uma liberação de nêutrons, que bombardearão outros núcleos.
- d) fusão do 235U com 238U ocorre formação de neutrino, que bombardeará outros núcleos radioativos.
- e) fusão do 235U com 238U ocorre formação de outros elementos radioativos mais pesados, que desencadeiam novos processos de fusão.
- #89401
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
Em um experimento, colocou-se água até a metade da capacidade de um frasco de vidro e, em seguida, adicionaram-se três gotas de solução alcoólica de fenolftaleína. Adicionou-se bicarbonato de sódio comercial, em pequenas quantidades, até que a solução se tornasse rosa. Dentro do frasco, acendeu-se um palito de fósforo, o qual foi apagado assim que a cabeça terminou de queimar. Imediatamente, o frasco foi tampado. Em seguida, agitou-se o frasco tampado e observou-se o desaparecimento da cor rosa.
MATEUS, A. L. Química na cabeça. Belo Horizonte: UFMG, 2001 (adaptado).
A explicação para o desaparecimento da cor rosa é que, com a combustão do palito de fósforo, ocorreu o(a)
- a) formação de óxidos de caráter ácido.
- b) evaporação do indicador fenolftaleína.
- c) vaporização de parte da água do frasco.
- d) vaporização dos gases de caráter alcalino.
- e) aumento do pH da solução no interior do frasco.
- #89402
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
O permanganato de potássio (KMnO4) é um agente oxidante forte muito empregado tanto em nível laboratorial quanto industrial. Na oxidação de alcenos de cadeia normal, como o 1-fenil-1-propeno, ilustrado na figura, o KMnO4 é utilizado para a produção de ácidos carboxílicos.
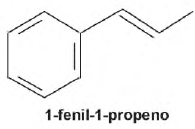
Os produtos obtidos na oxidação do alceno representado, em solução aquosa de KMnO4, são:
- a) Ácido benzoico e ácido etanoico.
- b) Ácido benzoico e ácido propanoico.
- c) Ácido etanoico e ácido 2-feniletanoico.
- d) Ácido 2-feniletanoico e ácido metanoico.
- e) Ácido 2-feniletanoico e ácido propanoico.
- #89403
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
Uma forma de organização de um sistema biológico é a presença de sinais diversos utilizados pelos indivíduos para se comunicarem. No caso das abelhas da espécieApis mellifera, os sinais utilizados podem ser feromônios. Para saírem e voltarem de suas colmeias, usam um feromônio que indica a trilha percorrida por elas (Composto A). Quando pressentem o perigo, expelem um feromônio de alarme (Composto B), que serve de sinal para um combate coletivo. O que diferencia cada um desses sinais utilizados pelas abelhas são as estruturas e funções orgânicas dos feromônios.
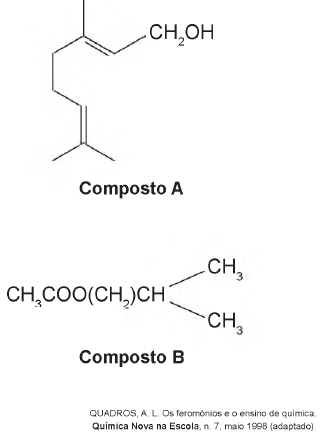
As funções orgânicas que caracterizam os feromônios de trilha e de alarme são, respectivamente,
- a) álcool e éster.
- b) aldeído e cetona.
- c) éter e hidrocarboneto.
- d) enol e ácido carboxílico.
- e) ácido carboxílico e amida.
- #89404
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
Alimentos em conserva são frequentemente armazenados em latas metálicas seladas, fabricadas com um material chamado folha de flandres, que consiste de uma chapa de aço revestida com uma fina camada de estanho, metal brilhante e de difícil oxidação. É comum que a superfície interna seja ainda revestida por uma camada de verniz à base de epóxi, embora também existam latas sem esse revestimento, apresentando uma camada de estanho mais espessa.
SANTANA, V. M. S. A leitura e a química das substâncias. Cadernos PDE. Ivaiporã: Secretaria de Estado da Educação do Paraná (SEED); Universidade Estadual de Londrina, 2010 (adaptado).
Comprar uma lata de conserva amassada no supermercado é desaconselhável porque o amassado pode
- a) alterar a pressão no interior da lata, promovendo a degradação acelerada do alimento.
- b) romper a camada de estanho, permitindo a corrosão do ferro e alterações do alimento.
- c) prejudicar o apelo visual da embalagem, apesar de não afetar as propriedades do alimento.
- d) romper a camada de verniz, fazendo com que o metal tóxico estanho contamine o alimento.
- e) desprender camadas de verniz, que se dissolverão no meio aquoso, contaminando o alimento.

