Simulado ENEM | QUÍMICA | ENEM
SIMULADO ENEM | QUÍMICA
INSTRUÇÕES DESTE SIMULADO
OBJETIVOS DO SIMULADO
Aprimorar os conhecimentos adquiridos durante os seus estudos, de forma a avaliar a sua aprendizagem, utilizando para isso as metodologias e critérios idênticos aos maiores e melhores concursos públicos do País, através de simulado para ENEM, prova do ENEM e/ou questões do ENEM.
PÚBLICO ALVO DO SIMULADO
Alunos que almejam sua aprovação no ENEM. Que desejam tirar excelentes notas na prova do ENEM deste ano.
SOBRE AS QUESTÕES DO SIMULADO
Este simulado contém questões do ENEM e da banca INEP. Estas questões são especificamente para o Aluno ENEM , contendo QUÍMICA que foram extraídas de provas anteriores, portanto este simulado contém os gabaritos oficiais destas provas do ENEM.
ESTATÍSTICA DO SIMULADO
O simulado ENEM | QUÍMICA contém um total de 20 questões com um tempo estimado de 60 minutos para sua realização. O assunto abordado é diversificado para que você possa realmente simular como esta seus conhecimentos.
RANKING DO SIMULADO
Realize este simulado até o seu final e ao conclui-lo você verá as questões que errou e acertou, seus possíveis comentários e ainda poderá ver seu DESEMPENHO perante ao dos seus CONCORRENTES. Venha participar deste Ranking do ENEM e saia na frente de todos. Veja sua nota e sua colocação e saiba se esta preparado para conseguir sua aprovação.
Bons Estudos! Simulado para o ENEM é aqui!
- #88931
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
Ácido muriático (ou ácido clorídrico comercial) é bastante utilizado na limpeza pesada de pisos para remoção de resíduos de cimento, por exemplo. Sua aplicação em resíduos contendo quantidades apreciáveis de CaCO3 resulta na liberação de um gás. Considerando a ampla utilização desse ácido por profissionais da área de limpeza, torna-se importante conhecer os produtos formados durante seu uso.
A fórmula do gás citado no texto e um teste que pode ser realizado para confirmar sua presença são, respectivamente:
- a) CO2 e borbulhá-lo em solução de K Cℓ
- b) CO2 e borbulhá-lo em solução de HNO3
- c) H2 e borbulhá-lo em solução de NaOH
- d) H2 e borbulhá-lo em solução de H2SO4
- e) CO2 e borbulhá-lo em solução Ba(OH)2
- #89112
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
O polímero PET (tereftalato de polietileno), material presente em diversas embalagens descartáveis, pode levar centenas de anos para ser degradado e seu processo de reciclagem requer um grande aporte energético. Nesse contexto, uma técnica que visa baratear o processo foi implementada recentemente. Trata-se do aquecimento de uma mistura de plásticos em um reator, a 700 °C e 34 atm, que promove a quebra das ligações químicas entre átomos de hidrogênio e carbono na cadeia do polímero, produzindo gás hidrogênio e compostos de carbono que podem ser transformados em microesferas para serem usadas em tintas, lubrificantes, pneus, dentre outros produtos.
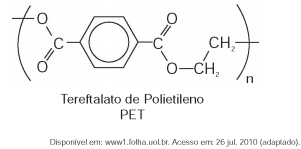
Considerando o processo de reciclagem do PET, para tratar 1 000 g desse polímero, com rendimento de 100%, o volume de gás hidrogênio liberado, nas condições apresentadas, encontra-se no intervalo entre
Dados: Constante dos gases R = 0,082 L atm/mol K; Massa molar do monômero do PET = 192 g/mol; Equação de estado dos gases ideais: PV = nRT
- a) 0 e 20 litros.
- b) 20 e 40 litros.
- c) 40 e 60 litros.
- d) 60 e 80 litros.
- e) 80 e 100 litros.
- #89113
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
O armazenamento de certas vitaminas no organismo apresenta grande dependência de sua solubilidade. Por exemplo, vitaminas hidrossolúveis devem ser incluídas na dieta diária, enquanto vitaminas lipossolúveis são armazenadas em quantidades suficientes para evitar doenças causadas pela sua carência. A seguir são apresentadas as estruturas químicas de cinco vitaminas necessárias ao organismo.
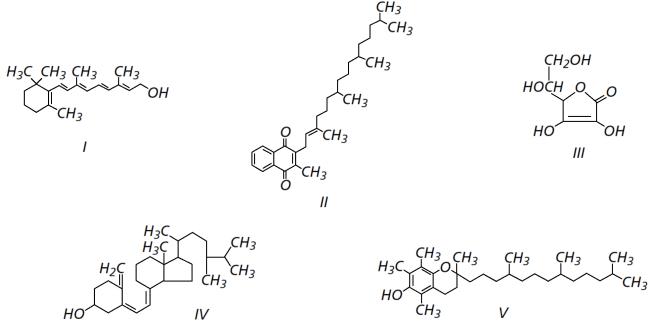
Dentre as vitaminas apresentadas na figura, aquela que necessita de maior suplementação diária é
- a) I.
- b) II.
- c) III.
- d) IV.
- e) V
- #89124
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
Os tubos de PVC, material organoclorado sintético, são normalmente utilizados como encanamento na construção civil. Ao final da sua vida útil, uma das formas de descarte desses tubos pode ser a incineração. Nesse processo libera-se![]() , cloreto de hidrogênio, dentre outras substâncias. Assim, é necessário um tratamento para evitar o problema da emissão desse poluente.
, cloreto de hidrogênio, dentre outras substâncias. Assim, é necessário um tratamento para evitar o problema da emissão desse poluente.
Entre as alternativas possíveis para o tratamento, é apropriado canalizar e borbulhar os gases provenientes da incineração em
- a) água dura.
- b) água de cal.
- c) água salobra.
- d) água destilada.
- e) água desmineralizada.
- #89138
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
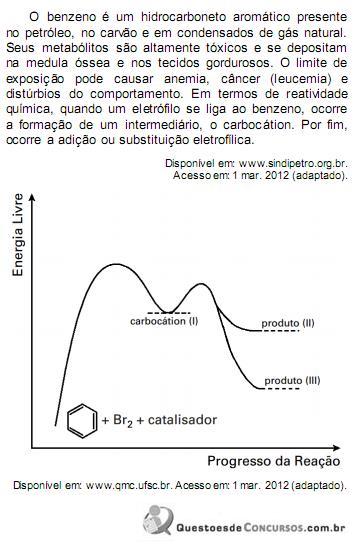
Com base no texto e no gráfico do progresso da reação apresentada, as estruturas químicas encontradas em I, II e III são, respectivamente:
- a)
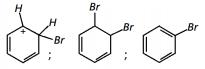
- b)
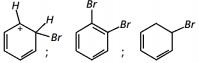
- c)
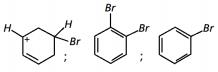
- d)
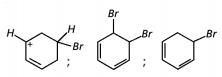
- e)
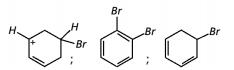
- #89143
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
A matéria-prima básica para a fabricação de calçados plásticos é a resina de PVC. A seguir é apresentado o fluxograma de fabricação do PVC e sua fórmula química.
Siglas: PVC - policloreto de vinila; EDC - dicloro etano; MVC - monocloreto de vinila
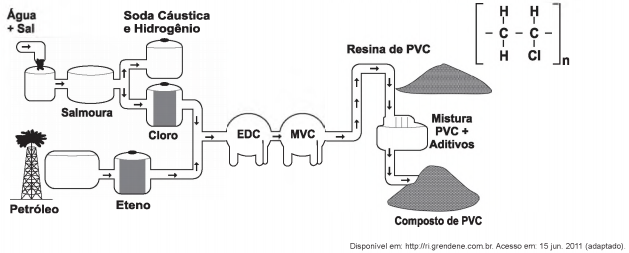
Para a produção do PVC, a obtenção do cloro é proveniente do processo de
- a) destilação.
- b) eletrólise.
- c) fusão ígnea.
- d) filtração a vácuo.
- e) precipitação fracionada.
- #89148
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
Estudos mostram que a prática de esportes pode aumentar a produção de radicais livres, um subproduto da nossa respiração que está ligado ao processo de envelhecimento celular e ao surgimento de doenças como o câncer. Para neutralizar essas moléculas nas células, quem faz esporte deve dar atenção especial aos antioxidantes. As vitaminas C, E e o selênio fazem parte desse grupo.
SÁ, V. Exercícios bem nutridos. Disponível em: http://saude.abril.com.br. Acesso em: 29 abr. 2010.(adaptado).
A ação antioxidante das vitaminas C e E e do selênio deve-se às suas capacidades de
- a) reagir com os radicais livres gerados no metabolismo celular através do processo de oxidação.
- b) diminuir a produção de oxigênio no organismo e o processo de combustão que gera radicais livres.
- c) aderir à membrana das mitocôndrias, interferindo no mecanismo de formação desses radicais livres.
- d) inibir as reações em cadeia utilizadas no metabolismo celular para geração dos radicais.
- e) induzir a adaptação do organismo em resposta à geração desses radicais.
- #89157
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
Os refrigerantes têm-se tornado cada vez mais o alvo de políticas públicas de saúde. Os de cola apresentam ácido fosfórico, substância prejudicial à fixação de cálcio, o mineral que é o principal componente da matriz dos dentes. A cárie é um processo dinâmico de desequilíbrio do processo de desmineralização dentária, perda de minerais em razão da acidez. Sabe- se que o principal componente do esmalte do dente é um sal denominado hidroxiapatita. O refrigerante, pela presença da sacarose, faz decrescer o pH do biofilme (placa bacteriana), provocando a desmineralização do esmalte dentário. Os mecanismos de defesa salivar levam de 20 a 30 minutos para normalizar o nível do pH, remineralizando o dente. A equação química seguinte representa esse processo:

Considerando que uma pessoa consuma refrigerantes diariamente, poderá ocorrer um processo de desmineralização dentária, devido ao aumento da concentração de
- a) OH_, que reage com os íons Ca 2+ , deslocando o equilíbrio para a direita.
- b) H+, que reage com as hidroxilas O H - , deslocando o equilíbrio para a direita.
- c) OH_, que reage com os íons Ca 2+ , deslocando o equilíbrio para a esquerda.
- d) H+, que reage com as hidroxilas OH - , deslocando o equilíbrio para a esquerda.
- e) Ca 2+ , que reage com as hidroxilas OH - , deslocando o equilíbrio para a esquerda.
- #89159
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
A bile é produzida pelo fígado, armazenada na vesícula biliar e tem papel fundamental na digestão de lipídeos. Os sais biliares são esteroides sintetizados no fígado a partir do colesterol, e sua rota de síntese envolve várias etapas. Partindo do ácido cólico representado na figura, ocorre a formação dos ácidos glicocólico e taurocólico; o prefixo glico- significa a presença de um resíduo do aminoácido glicina e o prefixo tauro-, do aminoácido taurina.
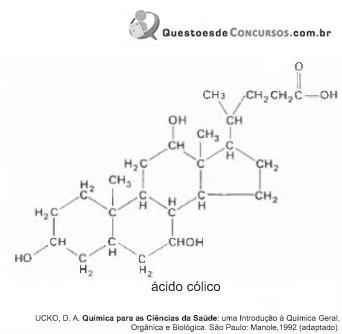
A combinação entre o ácido cólico e a glicina ou taurina origina a função amida, formada pela reação entre o grupo amina desses aminoácidos e o grupo
- a) carboxila do ácido cólico.
- b) aldeído do ácido cólico.
- c) hidroxila do ácido cólico.
- d) cetona do ácido cólico.
- e) éster do ácido cólico.
- #89160
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
A pele humana, quando está bem hidratada, adquire boa elasticidade e aspecto macio e suave. Em contrapartida, quando está ressecada, perde sua elasticidade e se apresenta opaca e áspera. Para evitar o ressecamento da pele é necessário, sempre que possível, utilizar hidratantes umectantes, feitos geralmente à base de glicerina e polietilenoglicol:
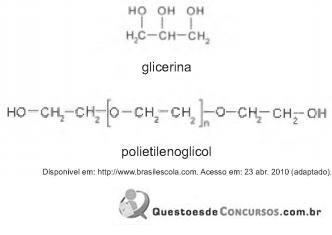
A retenção de água na superfície da pele promovida pelos hidratantes é consequência da interação dos grupos hidroxila dos agentes umectantes com a umidade contida no ambiente por meio de
- a) ligações iônicas.
- b) forças de London.
- c) ligações covalentes.
- d) forças dipolo-dipolo.
- e) ligações de hidrogênio.
- #89161
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
Cientistas da Austrália descobriram um meio de produzir roupas que se limpam sozinhas. A equipe de pesquisadores usou nanocristais de dióxido de titânio (TiO2) que, sob ação da luz solar, são capazes de decompor as partículas de sujeira na superfície de um tecido. O estudo apresentou bons resultados com fibras de algodão e seda. Nesses casos, foram removidas manchas de vinho, bastante resistentes. A nanocamada protetora poderá ser útil na prevenção de infecções em hospitais, uma vez que o dióxido de titânio também mostrou ser eficaz na destruição das paredes celulares de microrganismos que provocam infecções. O termo nano vem da unidade de medida nanômetro, que é a bilionésima parte de 1 metro.
Veja. Especial Tecnologia. São Paulo: Abril, set. 2008 (adaptado).
A partir dos resultados obtidos pelos pesquisadores em relação ao uso de nanocristais de dióxido de titânio na produção de tecidos e considerando uma possível utilização dessa substância no combate às infecções hospitalares, pode-se associar que os nanocristais de dióxido de titânio
- a) são pouco eficientes em ambientes fechados e escuros.
- b) possuem dimensões menores que as de seus átomos formadores.
- c) são pouco eficientes na remoção de partículas de sujeira de natureza orgânica.
- d) destroem microrganismos causadores de infecções, por meio de osmose celular.
- e) interagem fortemente com material orgânico devido à sua natureza apolar.
- #89162
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
Devido ao seu alto teor de sais, a água do mar é imprópria para o consumo humano e para a maioria dos usos da água doce. No entanto, para a indústria, a água do mar é de grande interesse, uma vez que os sais presentes podem servir de matérias-primas importantes para diversos processos. Nesse contexto, devido a sua simplicidade e ao seu baixo potencial de impacto ambiental, o método da precipitação fracionada tem sido utilizado para a obtenção dos sais presentes na água do mar.
Tabela 1: Solubilidade em água de alguns compostos presentes na água do mar a 25 oC
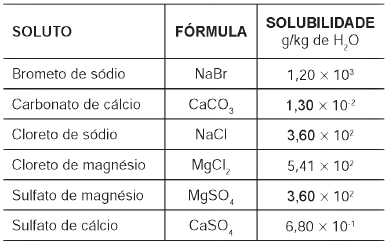
Pitombo, L.R.M.; Marcondes, M.E.R.; GEPEC. Grupo de pesquisa em Educação em Química. Química e Sobrevivência: Hidrosfera Fonte de Materiais. São Paulo: EDUSP, 2005 (adaptado).
Suponha que uma indústria objetiva separar determinados sais de uma amostra de água do mar a 25 °C, por meio da precipitação fracionada. Se essa amostra contiver somente os sais destacados na tabela, a seguinte ordem de precipitação será verificada:
- a) Carbonato de cálcio, sulfato de cálcio, cloreto de sódio e sulfato de magnésio, cloreto de magnésio e, por último, brometo de sódio.
- b) Brometo de sódio, cloreto de magnésio, cloreto de sódio e sulfato de magnésio, sulfato de cálcio e, por último, carbonato de cálcio.
- c) Cloreto de magnésio, sulfato de magnésio e cloreto de sódio, sulfato de cálcio, carbonato de cálcio e, por último, brometo de sódio.
- d) Brometo de sódio, carbonato de cálcio, sulfato de cálcio, cloreto de sódio e sulfato de magnésio e, por último, cloreto de magnésio.
- e) Cloreto de sódio, sulfato de magnésio, carbonato de cálcio, sulfato de cálcio, cloreto de magnésio e, por último, brometo de sódio.
- #89163
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
O flúor é usado de forma ampla na prevenção de cáries. Por reagir com a hidroxiapatita [Ca10(PO4)6(OH)2] presente nos esmaltes dos dentes, o flúor forma a fluorapatita [Ca10(PO4)6F2], um mineral mais resistente ao ataque ácido decorrente da ação de bactérias específicas presentes nos açúcares das placas que aderem aos dentes.
Disponível em: http://www.odontologia.com.br. Acesso em: 27 jul. 2010 (adaptado).
A reação de dissolução da hidroxiapatita é:
![]()
Dados: Massas molares em g/mol — [Ca10(PO4)6(OH2)] = 1004; HPO42 = 96; Ca = 40.
Supondo-se que o esmalte dentário seja constituído exclusivamente por hidroxiapatita, o ataque ácido que dissolve completamente 1 mg desse material ocasiona a formação de, aproximadamente,
- a) 0,14 mg de íons totais.
- b) 0,40 mg de íons totais.
- c) 0,58 mg de íons totais.
- d) 0,97 mg de íons totais.
- e) 1,01 mg de íons totais.
- #89164
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
O rótulo de uma garrafa de água mineral natural contém as seguintes informações:
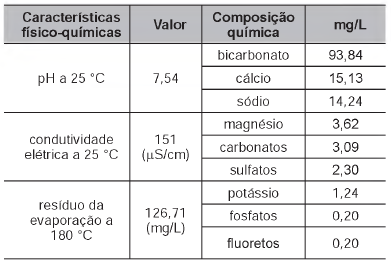
As informações químicas presentes no rótulo de vários produtos permitem classificar o produto de várias formas, de acordo com seu gosto, seu cheiro, sua aparência, sua função, entre outras. As informações da tabela permitem concluir que essa água é
- a) gasosa.
- b) insípida.
- c) levemente azeda.
- d) um pouco alcalina.
- e) radioativa na fonte.
- #89165
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
Decisão de asfaltamento da rodovia MG-010, acompanhada da introdução de espécies exóticas, e a prática de incêndios criminosos, ameaçam o sofisticado ecossistema do campo rupestre da reserva da Serra do Espinhaço. As plantas nativas desta região, altamente adaptadas a uma alta concentração de alumínio, que inibe o crescimento das raízes e dificultam a absorção de nutrientes e água, estão sendo substituídas por espécies invasoras que não teriam naturalmente adaptação para este ambiente, no entanto elas estão dominando as margens da rodovia, equivocadamente chamada de “estrada ecológica” . Possivelmente a entrada de espécies de plantas exóticas neste ambiente foi provocada pelo uso, neste empreendimento, de um tipo de asfalto (cimento-solo), que possui uma mistura rica em cálcio, que causou modificações químicas aos solos adjacentes à rodovia MG-010. Scientific American. Brasil. Ano 7, n° 79, 2008 (adaptado). Essa afirmação baseia-se no uso de cimento-solo, mistura rica em cálcio que
- a) inibe a toxicidade do alumínio, elevando o pH dessas áreas.
- b) inibe a toxicidade do alumínio, reduzindo o pH dessas áreas.
- c) aumenta a toxicidade do alumínio, elevando o pH dessas áreas.
- d) aumenta a toxicidade do alumínio, reduzindo o pH dessas áreas.
- e) neutraliza a toxicidade do alumínio, reduzindo o pH dessas áreas.

