Questões de Química Enem | CONCURSO
QUESTÕES DE QUÍMICA ENEM
INSTRUÇÕES DO SIMULADO
OBJETIVOS
Aprimorar os conhecimentos adquiridos durante os seus estudos, de forma a avaliar a sua aprendizagem, utilizando para isso as metodologias e critérios idênticos aos maiores e melhores Concurso do País, através de simulados para Concurso, provas e questões de Concurso.
PÚBLICO ALVO DO SIMULADO
Alunos/Concursando que almejam sua aprovação no Concurso ENEM .
SOBRE AS QUESTÕES DO SIMULADO
Este simulado contém questões da ENEM que foi organizado pela INEP . Estas questões são de Química
, contendo os assuntos de Assuntos Diversos que foram extraídas dos Concurso anteriores ENEM , portanto este simulado contém os gabaritos oficiais.
ESTATÍSTICA DO SIMULADO
O Questões de Química Enem contém um total de 20 questões de Concurso com um tempo estimado de 60 minutos para sua realização. Os assuntos abordados são de Química
, Assuntos Diversos para que você possa realmente simular como estão seus conhecimento no Concurso ENEM .
RANKING DO SIMULADO
Realize este simulado até o seu final e ao conclui-lo você verá as questões que errou e acertou, seus possíveis comentários e ainda poderá ver seu DESEMPENHO perante ao dos seus CONCORRENTES no Concurso ENEM . Venha participar deste Ranking e saia na frente de todos. Veja sua nota e sua colocação no RANKING e saiba se esta preparado para conseguir sua aprovação.
CARGO DO SIMULADO
Este simulado contém questões para o cargo de Cargos diversos. Se você esta estudando para ser aprovado para Cargos diversos não deixe de realizar este simulado e outros disponíveis no portal.
COMO REALIZAR O SIMULADO ENEM
Para realizar o simulado ENEM você deve realizar seu cadastro grátis e depois escolher as alternativas que julgar correta. No final do simulado ENEM você verá as questões que errou e acertou.
Bons Estudos! Simulado para ENEM é aqui!
- #174391
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
O Prêmio Nobel de Química de 2000 deveu-se à descoberta e ao desenvolvimento de polímeros condutores. Esses materiais têm ampla aplicação em novos dispositivos eletroluminescentes (LEDs), células fotovoltaicas etc. Uma propriedade-chave de um polímero condutor é a presença de ligações duplas conjugadas ao longo da cadeia principal do polímero.
ROCHA FILHO, R. C. Polímeros condutores: descoberta e aplicações. Química Nova na Escola, n. 12, 2000 (adaptado).
Um exemplo desse polímero é representado pela estrutura
- a)

- b)

- c)

- d)

- e)

- #174392
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
O alcoolômetro Gay Lussac é um instrumento destinado a medir o teor de álcool, em porcentagem de volume (v/v), de soluções de água e álcool na faixa de 0 °GL a 100 °GL, com divisões de 0,1 °GL. A concepção do alcoolômetro se baseia no princípio de flutuabilidade de Arquimedes, semelhante ao funcionamento de um densímetro. A escala do instrumento é aferida a 20 °C, sendo necessária a correção da medida, caso a temperatura da solução não esteja na temperatura de aferição. É apresentada parte da tabela de correção de um alcoolômetro, com a temperatura.
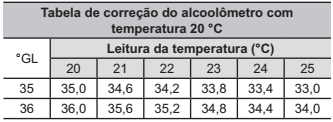
Manual alcoolômetro Gay Lussac. Disponível em: www.incoterm.com.br. Acesso em: 4 dez. 2018 (adaptado).
É necessária a correção da medida do instrumento, pois um aumento na temperatura promove o(a)
- a) aumento da dissociação da água.
- b) aumento da densidade da água e do álcool.
- c) mudança do volume dos materiais por dilatação.
- d) aumento da concentração de álcool durante a medida.
- e) alteração das propriedades químicas da mistura álcool e água.
- #174393
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
O quadro lista alguns dispositivos eletrônicos que estão presentes no dia a dia, bem como a faixa de força eletromotriz necessária ao seu funcionamento.
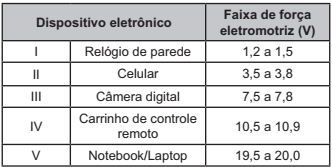
Considere que uma bateria é construída pela associação em série de três pilhas de lítio-iodo, nas condições-padrão, conforme as semiequações de redução apresentadas.
I2 + 2 e- → 2 I- E° = + 0,54V
Li+ + e- → Li E° = - 3,05 V
Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?
- a) I
- b) II
- c) III
- d) IV
- e) V
- #174394
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
Os tanques de armazenamento de gasolina podem, com o tempo, sofrer processos oxidativos, resultando na contaminação do combustível e do solo à sua volta. Uma forma de evitar tais problemas econômicos e ambientais é utilizar preferencialmente metais de sacrifício, protegendo os tanques de armazenamento.
Suponha que seja necessário usar um metal de sacrifício em um tanque de aço (liga de ferro-carbono). Considere as semirreações de redução e seus respectivos potenciais padrão.

Dos metais citados, o que garantirá proteção ao tanque de aço é o
- a) zinco.
- b) cobre.
- c) níquel.
- d) cádmio.
- e) mercúrio.
- #174395
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
A pentano-5-lactama é uma amida cíclica que tem aplicações na síntese de fármacos e pode ser obtida pela desidratação intramolecular, entre os grupos funcionais de ácido carboxílico e amina primária, provenientes de um composto de cadeia alifática, saturada, normal e homogênea.

O composto que, em condições apropriadas, dá origem a essa amida cíclica é
- a) CH3NHCH2CH2CH2CO2H.
- b) HOCH=CHCH2CH2CONH2 .
- c) CH2 (NH2 )CH2 CH=CHCO2H.
- d) CH2 (NH2 )CH2CH2CH2CO2H.
- e) CH2 (NH2 )CH(CH3 )CH2CO2H.
- #174396
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
Com a descoberta de emissões de energia do rádio-226, por Marie Curie e Pierre Curie, o fenômeno foi denominado radiação α (alfa) ou emissão α. Posteriormente, verificou-se que a emissão α na verdade são partículas correspondentes a núcleos de hélio formados por dois prótons e dois nêutrons. Assim, no decaimento α, um núcleo instável emite partículas α, tornando-se um núcleo mais estável (núcleo filho).
Se um núcleo de rádio-226 emitir duas partículas α, o número de massa do núcleo filho será
- a) 226.
- b) 224.
- c) 222.
- d) 220.
- e) 218.
- #174397
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
A agricultura de frutas cítricas requer que o valor do pH do solo esteja na faixa ideal entre 5,8 e 6,0. Em uma fazenda, o valor do pH do solo é 4,6. O agricultor resolveu testar três produtos de correção de pH em diferentes áreas da fazenda. O primeiro produto possui íons sulfato e amônio, o segundo produto possui íons carbonato e cálcio e o terceiro produto possui íons sulfato e sódio.
O íon que vai produzir o efeito desejado de correção no valor do pH é o
- a) cálcio, porque sua hidrólise produz H+, que aumenta a acidez.
- b) amônio, porque sua hidrólise produz H+, que aumenta a acidez.
- c) sódio, porque sua hidrólise produz OH−, que aumenta a alcalinidade.
- d) sulfato, porque sua hidrólise produz OH−, que aumenta a alcalinidade.
- e) carbonato, porque sua hidrólise produz OH−, que aumenta a alcalinidade.
- #174398
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
Uma lagarta ao comer as folhas do milho, induz no vegetal a produção de óleos voláteis cujas estruturas estão mostradas a seguir:

A volatilidade desses óleos é decorrência do(a)
- a) elevado caráter covalente.
- b) alta miscibilidade em água.
- c) baixa estabilidade química.
- d) grande superfície de contato.
- e) fraca interação intermolecular.
- #174399
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
Um princípio importante na dissolução de solutos é que semelhante dissolve semelhante. Isso explica, por exemplo, o açúcar se dissolver em grandes quantidades na água, ao passo que o óleo não se dissolve.

A dissolução na água, do soluto apresentado, ocorre predominantemente por meio da formação de
- a) ligações iônicas.
- b) ligações covalentes.
- c) interações íon-dipolo.
- d) ligações de hidrogênio.
- e) interações hidrofóbicas.
- #174400
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
Quando as pilhas, que contêm metais pesados, são descartadas no lixo comum, pode ocorrer o rompimento de sua blindagem e a liberação de seu conteúdo para o meio ambiente. Ao atingir o solo, um metal pesado pode ficar retido nas camadas superiores por três processos: reação com moléculas orgânicas que possuam oxigênio ou nitrogênio em sua estrutura, adsorção em argilas e minerais e reação com grupamento hidroxila, sulfeto ou metil, formando precipitado insolúvel.
Com bases nas informações apresentadas, são suscetíveis de serem formados no solo os compostos:
- a) CdS e Zn(OH)2
- b) Pb(OH)2 e Na2S
- c) Ni(OH)2 e Cr(C2H5 )2
- d) CdSO4 e Pb(CH3CO2 )2
- e) Hg(CH3 )2 e Ca(CH3CO2 )2
- #174401
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 11 -
O propranolol é um fármaco pouco solúvel em água utilizado no tratamento de algumas doenças cardiovasculares. Quando essa substância é tratada com uma quantidade estequiométrica de um ácido de Brönsted-Lowry, o grupamento de maior basicidade reage com o próton levando à formação de um derivado solúvel em água.

GONSALVES, A. A. et al. Contextualizando reações ácido-base de acordo com a teoria protônica de Brönsted-Lowry usando comprimidos de propranolol e nimesulida. Química Nova, n. 8, 2013 (adaptado).
O ácido de Brönsted-Lowry reage com
- a) a hidroxila alcoólica.
- b) os anéis aromáticos.
- c) as metilas terminais.
- d) o grupamento amina.
- e) o oxigênio do grupamento éter.
- #174402
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 12 -
Um cidadão que se mudou de Brasília para Recife, após algum tempo, percebeu que partes de seu carro estavam enferrujando muito rapidamente. Perguntou para seu filho, estudante do ensino médio, a explicação para o fenômeno. O filho pesquisou na internet e descobriu que, por causa da maresia, gotículas de água do mar atingem os objetos de aço (liga de ferro e carbono) e intensificam sua corrosão. Com base nessa informação, o estudante explicou corretamente ao pai o efeito do cloreto de sódio na corrosão.
A explicação correta de a maresia acelerar a corrosão do aço é porque
- a) reduz o ferro.
- b) oxida o carbono.
- c) dissolve a pintura do carro.
- d) torna a água mais condutora.
- e) diminui a dissolução do oxigênio na água.
- #174403
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 13 -
O peróxido de hidrogênio é um produto secundário do metabolismo celular e apresenta algumas funções úteis, mas, quando em excesso, é prejudicial, gerando radicais que são tóxicos para as células. Para se defender, o organismo vivo utiliza a enzima catalase, que decompõe H2O2 em H2O e O2 . A energia de reação de decomposição, quando na presença e ausência da catalase, está mostrada no gráfico.

Disponível em: www.pontociencia.org.br. Acesso em: 14 ago. 2013 (adaptado).
Na situação descrita, o organismo utiliza a catalase porque ela
- a) diminui a energia de ativação.
- b) permite maior rendimento da reação.
- c) diminui o valor da entalpia da reação.
- d) consome rapidamente o oxigênio do reagente.
- e) reage rapidamente com o peróxido de hidrogênio.
- #174404
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 14 -
O carvão é um combustível que tem várias substâncias em sua composição. Em razão disso, quando é representada sua queima com o oxigênio (massa molar 16 g mol−1), simplifica-se elaborando apenas a combustão completa do carbono (massa molar 12 g mol−1). De acordo com o conteúdo médio de carbono fixo, o carvão é classificado em vários tipos, com destaque para o antracito, que apresenta, em média, 90% de carbono. Esse elevado conteúdo favorece energeticamente a combustão, no entanto, libera maior quantidade de gás que provoca efeito estufa.
Supondo a queima completa de 100 g de carvão antracito, a massa de gás liberada na atmosfera é, em grama, mais próxima de
- a) 90,0.
- b) 210,0.
- c) 233,3.
- d) 330,0.
- e) 366,7.
- #174405
- Banca
- INEP
- Matéria
- Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 15 -
A presença de substâncias ricas em enxofre, como a pirita (FeS2 ), em áreas de mineração, provoca um dos mais preocupantes impactos causados pela exploração dos recursos naturais da crosta terrestre. Em contato com o oxigênio atmosférico, o sulfeto sofre oxidação em diversas etapas até formar uma solução aquosa conhecida como drenagem ácida de minas, de acordo com a equação química descrita.
4 FeS2 (s) + 15 O2 (g) + 2 H2 O (l) → 2 Fe2 (SO4 )3 (aq) + 2 H2 SO4 (aq)
Um dos processos de intervenção nesse problema envolve a reação do resíduo ácido com uma substância básica, de baixa solubilidade em meio aquoso, e sem a geração de subprodutos danosos ao meio ambiente.
FIGUEIREDO, B. R. Minérios e ambientes. Campinas: Unicamp, 2000.
Esse processo de intervenção é representado pela equação química:
- a) Ca (s) + 2 H2 O (l) → Ca(OH)2 (aq) + H2 (g).
- b) CaO (s) + H2 SO4 (aq) → CaSO4 (aq) + H2 O (l).
- c) CaCO3 (s) + H2 SO4 (aq) → CaSO4 (aq) + H2 O (l) + CO2 (g).
- d) CaSO4 (s) + H2 SO4 (aq) → Ca2+ (aq) + 2 H+ (aq) + 2 SO4 2− (aq).
- e) Ca(HCO3 ) 2 (s) + 2 H2 O(l) → Ca(OH)2 (aq) + 2 H2 O (l) + 2 CO2 (g).

