Prova Equilíbrio Químico para o Enem | ENEM
PROVA EQUILÍBRIO QUÍMICO PARA O ENEM
INSTRUÇÕES DO SIMULADO
OBJETIVOS
Aprimorar os conhecimentos adquiridos durante os seus estudos, de forma a avaliar a sua aprendizagem, utilizando para isso as metodologias e critérios idênticos aos maiores e melhores do País, através de simulados para , provas e questões de .
PÚBLICO ALVO DO SIMULADO
Alunos/Concursando que almejam sua aprovação no ENEM.
SOBRE AS QUESTÕES DO SIMULADO
Este simulado contém questões da ENEM que foi organizado pela bancas diversas. Estas questões são de Equilíbrio Químico, contendo os assuntos de Assuntos Diversos que foram extraídas dos anteriores ENEM, portanto este simulado contém os gabaritos oficiais.
ESTATÍSTICA DO SIMULADO
O Prova Equilíbrio Químico para o Enem contém um total de 10 questões de com um tempo estimado de 30 minutos para sua realização. Os assuntos abordados são de Equilíbrio Químico, Assuntos Diversos para que você possa realmente simular como estão seus conhecimento no ENEM.
RANKING DO SIMULADO
Realize este simulado até o seu final e ao conclui-lo você verá as questões que errou e acertou, seus possíveis comentários e ainda poderá ver seu DESEMPENHO perante ao dos seus CONCORRENTES no ENEM. Venha participar deste Ranking e saia na frente de todos. Veja sua nota e sua colocação no RANKING e saiba se esta preparado para conseguir sua aprovação.
CARGO DO SIMULADO
Este simulado contém questões para o cargo de Aluno ENEM. Se você esta estudando para ser aprovado para Aluno ENEM não deixe de realizar este simulado e outros disponíveis no portal.
COMO REALIZAR O SIMULADO ENEM
Para realizar o simulado ENEM você deve realizar seu cadastro grátis e depois escolher as alternativas que julgar correta. No final do simulado ENEM você verá as questões que errou e acertou.
Bons Estudos! Simulado para ENEM é aqui!
- #188506
- Banca
- . Bancas Diversas
- Matéria
- Equilíbrio Químico
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
O reagente conhecido como Kastle-Meyer é muito utilizado por investigadores criminais para detectar a presença de sangue. Trata-se de uma solução aquosa incolor, preparada com zinco metálico, hidróxido de sódio (Reação 1) e indicador (Reação 2). Essa solução, quando em contato com a hemoglobina contida no sangue e na presença de água oxigenada (Reação 3), passa de incolor para vermelha, indicando a presença de sangue no local, conforme as reações descritas.
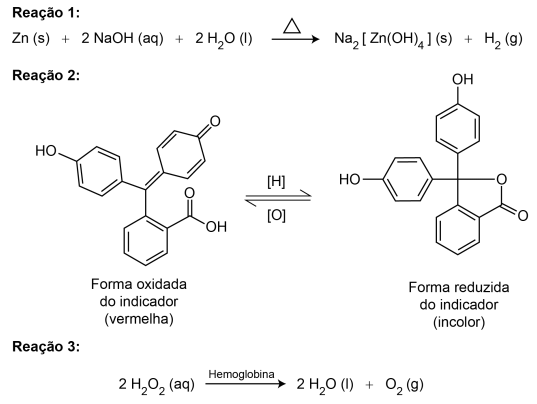
DIAS FILHO, C. R.; ANTEDOMENICO, E. A perícia criminal e a interdisciplinaridade no ensino de ciências naturais. Química Nova na Escola, n. 2, maio 2010 (adaptado).
A mudança de coloração que indica a presença de sangue ocorre por causa da reação do indicador com o(a)
- a) sal de Na2[Zn(OH)4] na presença de hemoglobina.
- b) água produzida pela decomposição da água oxigenada
- c) hemoglobina presente na reação com a água oxigenada.
- d) gás oxigênio produzido pela decomposição da água oxigenada.
- e) gás hidrogênio produzido na reação do zinco com hidróxido de sódio.
- #188507
- Banca
- . Bancas Diversas
- Matéria
- Equilíbrio Químico
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
Uma das etapas do tratamento da água é a desinfecção, sendo a cloração o método mais empregado. Esse método consiste na dissolução do gás cloro numa solução sob pressão e sua aplicação na água a ser desinfectada. As equações das reações químicas envolvidas são:
Cl2 (g) + 2 H2O ( l ) ⥨ HCIO (aq) + H3O+ (aq) + Cl (aq)
HCIO (aq) + H2O (I) ⥨ H3O+ (aq) + CIO- (aq) pKa = - log Ka = 7,53
A ação desinfetante é controlada pelo ácido hipocloroso, que possui um potencial de desinfecção cerca de 80 vezes superior ao ânion hipoclorito. O pH do meio é importante, porque influencia na extensão com que o ácido hipocloroso se ioniza.
Para que a desinfecção seja mais efetiva, o pH da água a ser tratada deve estar mais próximo de
- a) 0.
- b) 5.
- c) 7.
- d) 9.
- e) 14.
- #188508
- Banca
- . Bancas Diversas
- Matéria
- Equilíbrio Químico
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
Um pesquisador percebe que o rótulo de um dos vidros em que guarda um concentrado de enzimas digestivas está ilegível. Ele não sabe qual enzima o vidro contém, mas desconfia de que seja uma protease gástrica, que age no estômago digerindo proteínas. Sabendo que a digestão no estômago é ácida e no intestino é básica, ele monta cinco tubos de ensaio com alimentos diferentes, adiciona o concentrado de enzimas em soluções com pH determinado e aguarda para ver se a enzima age em algum deles.
O tubo de ensaio em que a enzima deve agir para indicar que a hipótese do pesquisador está correta é aquele que contém
- a) cubo de batata em solução com pH = 9.
- b) pedaço de carne em solução com pH = 5.
- c) clara de ovo cozida em solução com pH = 9.
- d) porção de macarrão em solução com pH = 5.
- e) bolinha de manteiga em solução com pH = 9.
- #188509
- Banca
- . Bancas Diversas
- Matéria
- Equilíbrio Químico
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
Alguns proflssionais burlam a fiscalização quando adicionam quantidades controladas de solução aquosa de hidróxido de sódio a tambores de leite de validade vencida. Assim que o teor de acidez, em termos de ácido lático, encontra-se na faixa permitida pela legislação, o leite adulterado passa a ser comercializado. A reação entre o hidróxido de sódio e o ácido lático pode ser representada pela equação química:
CH3CH(OH)COOH (aq) + NaOH (aq) → CH3CH(OH)COONa (aq) + H20 (I)
A consequência dessa adulteração é o(a)
- a) aumento do pH do leite.
- b) diluição significativa do leite.
- c) precipitação do lactato de sódio.
- d) diminuição da concentração de sais.
- e) aumento da concentração dos íons H+.
- #188510
- Banca
- . Bancas Diversas
- Matéria
- Equilíbrio Químico
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
Cinco indústrias de ramos diferentes foram instaladas ao longo do curso de um rio. O descarte dos efluentes dessas indústrias acarreta impacto na qualidade de suas águas. O pH foi determinado em diferentes pontos desse rio, a 25 °C, e os resultados são apresentados no quadro.
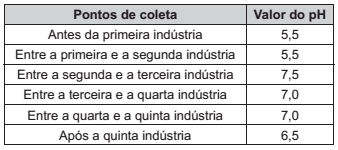
A indústria que descarta um efluente com características básicas é a
- a) primeira.
- b) segunda.
- c) terceira.
- d) quarta.
- e) quinta.
- #188511
- Banca
- . Bancas Diversas
- Matéria
- Equilíbrio Químico
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
A tabela lista os valores de pH de algumas bebidas consumidas pela população.

O esmalte dos dentes é constituído de hidroxiapatita (Ca5(PO4)3OH), um mineral que sofre desmineralização em meio ácido, de acordo com a equação química:
Ca5(PO4)3OH (s)

5 Ca2+ (aq) + 3 PO43- (aq) + OH- (aq)
Das bebidas listadas na tabela, aquela com menor potencial de desmineralização dos dentes é o
- a) chá.
- b) café.
- c) vinho.
- d) refrigerante.
- e) suco de limão.
- #188512
- Banca
- . Bancas Diversas
- Matéria
- Equilíbrio Químico
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
À medida que se expira sobre uma solução de azul de bromotimol e hidróxido de sódio (NaOH), sua coloração azul característica vai se alterando. O azul de bromotimol é um indicador ácido-base que adquire cor azul em pH básico, verde em pH neutro e amarela em pH ácido. O gás carbônico (CO2) expirado reage com a água presente na solução (H2O), produzindo ácido carbônico (H2CO3). Este pode reagir com o NaOH da solução inicial, produzindo bicarbonato de sódio (NaHCO3):
CO2 + H2O → H2CO3
H2CO3 + NaOH → NaHCO3 + H2O
ARROIO, A. et al. Química Nova na Escola, São Paulo, v. 29, 2006.
O que a pessoa irá observar à medida que expira no recipiente contendo essa solução?
- a) A solução mudará de cor, de azul para verde, e, em seguida, de verde para amarelo. Com o acréscimo de ácido carbônico, o pH da solução irá reduzir até tornar-se neutro. Em seguida, um excesso de ácido carbônico tornará o pH da solução ácido.
- b) A solução somente terá sua cor alterada de azul para amarelo, pois será formado um excesso de ácido carbônico no recipiente, o que reduzirá bruscamente o pH da solução.
- c) A cor da solução não será alterada com o acréscimo de ácido carbônico. Isso porque o meio é inicialmente neutro e a presença de ácido carbônico não produzirá nenhuma mudança no pH da solução.
- d) A solução mudará de azul para verde e, em seguida, de verde para azul. Isso ocorrerá em função da neutralização de um meio inicialmente básico acompanhado de um aumento de pH na solução, à medida que ácido carbônico é adicionado ao meio.
- e) A cor da solução alterará de azul para amarelo e, em seguida, de amarelo para verde. Esse comportamento é justificado pelo fato de o ácido carbônico reduzir bruscamente o pH da solução e depois ser neutralizado pelo restante de NaOH presente no meio.
- #188513
- Banca
- . Bancas Diversas
- Matéria
- Equilíbrio Químico
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
O pH do solo pode variar em uma faixa significativa devido a várias causas. Por exemplo, o solo de áreas com chuvas escassas, mas com concentrações elevadas do sal solúvel carbonato de sódio (Na2CO3), torna-se básico devido à reação de hidrólise do íon carbonato, segundo o equilíbrio:
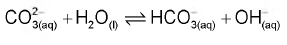
Esses tipos de solos são alcalinos demais para fins agrícolas e devem ser remediados pela utilização de aditivos químicos.
BAIRD, C. Química ambiental. São Paulo: Artmed, 1995 (adaptado).
Suponha que, para remediar uma amostra desse tipo de solo, um técnico tenha utilizado como aditivo a cal virgem (CaO). Nesse caso, a remediação
- a) foi realizada, pois o caráter básico da cal virgem promove o deslocamento do equilíbrio descrito para a direita, em decorrência da elevação de pH do meio.
- b) foi realizada, pois o caráter ácido da cal virgem promove o deslocamento do equilíbrio descrito para a esquerda, em decorrência da redução de pH do meio.
- c) não foi realizada, pois o caráter ácido da cal virgem promove o deslocamento do equilíbrio descrito para a direita, em decorrência da redução de pH do meio.
- d) não foi realizada, pois o caráter básico da cal virgem promove o deslocamento do equilíbrio descrito para a esquerda, em decorrência da elevação de pH do meio.
- e) não foi realizada, pois o caráter neutro da cal virgem promove o deslocamento do equilíbrio descrito para a esquerda, em decorrência da manutenção de pH do meio.
- #188514
- Banca
- . Bancas Diversas
- Matéria
- Equilíbrio Químico
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
O suco de repolho-roxo pode ser utilizado como indicador ácido-base em diferentes soluções. Para isso, basta misturar um pouco desse suco à solução desejada e comparar a coloração final com a escala indicadora de pH, com valores de 1 a 14, mostrada a seguir.

Utilizando-se o indicador ácido-base e a escala para determinar o pH da saliva humana e do suco gástrico, têm-se, respectivamente, as cores
- a) vermelha e vermelha.
- b) vermelha e azul.
- c) rosa e roxa
- d) roxa e amarela.
- e) roxa e vermelha.
- #188515
- Banca
- . Bancas Diversas
- Matéria
- Equilíbrio Químico
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
É possível identificar adulterantes do leite de vaca por meio da adição do indicador azul de bromofenol. A presença de agentes oxidantes provoca a descoloração do indicador, mantendo a cor branca na amostra, característica do leite. Substâncias redutoras presentes no leite reagem com o azul de bromofenol, gerando a cor verde. A diminuição do valor de pH do leite torna o indicador amarelo. Em pH mais elevado, o indicador adquire a cor violeta e, em meio neutro, a cor azul. Considere que um lote industrial de leite em embalagem longa vida foi adulterado com excesso de soda cáustica.
Em uma inspeção sanitária do lote adulterado, qual será a cor apresentada pelo leite após adição do indicador azul de bromofenol?
- a) Azul
- b) Verde
- c) Violeta
- d) Branco
- e) Amarelo

