(1,0)
Íons Ba2+(aq) são altamente tóxicos e suas soluções não podem ser descartadas na rede de esgoto. Esses íons devem, portanto, ser removidos de misturas que se pretende descartar, o que pode ser feito através de reações de precipitação. Para a remoção de íons Ba2+(aq) de 1,0 L de resíduo de concentração 0,01 mol L -1 foram propostos os seguintes procedimentos:
I. Adição de 0,1 L de solução de Na2CO3 0,1 mol L-1
II. Adição de 0,1 L de solução de Na2SO4 0,1 mol L-1
III. Adição de 0,1 L de solução de Na3PO4 0,01 mol L-1
IV. Adição de 0,1 L de solução de NaOH, 0,01 mol L-1
Dado: Constante do produto de solubilidade dos compostos de bário (Ks)
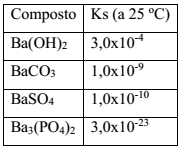
O procedimento que resulta na produção de um material mais adequado ao descarte é: