Tabela Periódica: Explorando a Organização dos Elementos Químicos
Tabela Periódica: Explorando a Organização dos Elementos Químicos
A Tabela Periódica, uma obra-prima na linguagem da química, desempenha um papel crucial ao consolidar e organizar os elementos químicos que compõem nosso vasto universo. Cada símbolo presente nessa tabela é mais do que uma simples representação; é uma porta de entrada para a compreensão das propriedades únicas de cada elemento, revelando um intricado mundo de partículas e interações.
Ao considerarmos os elementos em sua disposição específica na tabela, percebemos que não se trata apenas de um arranjo visual, mas de um mapa que revela padrões e regularidades fundamentais. Os elementos são dispostos em ordem crescente de seus números atômicos, proporcionando uma estrutura lógica que reflete a complexidade e a simplicidade inerentes à química. Essa organização não apenas simplifica o estudo dos elementos, mas também lança luz sobre suas propriedades, comportamentos e relações intrínsecas.
O estudo da Tabela Periódica é um mergulho fascinante nas bases da química, fornecendo aos cientistas e estudantes uma bússola confiável para navegar pelos intricados caminhos dos elementos. Este artigo explorará a história por trás dessa ferramenta valiosa, destacando como ela se tornou uma peça central no quebra-cabeça do entendimento científico. Vamos nos aprofundar nos elementos, desvendar padrões e apreciar a riqueza de conhecimento que a Tabela Periódica oferece àqueles que buscam desvendar os segredos do mundo microscópico da matéria.

Índice
- Organização da Tabela Periódica
- Períodos e Grupos na Tabela Periódica
- Elementos de Transição na Tabela Periódica
- Evolução da tabela periódica
1. Organização da Tabela Periódica
Explorando a Estrutura da Tabela Periódica: Períodos e Grupos
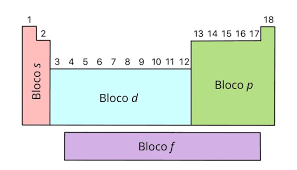
A Tabela Periódica é um tesouro organizado que desvenda a complexa arquitetura dos elementos químicos. Seu arranjo é meticulosamente estruturado em períodos e grupos, delineando padrões cruciais na composição dos átomos. Cada período, expresso em linhas horizontais, revela a quantidade de camadas eletrônicas presentes nos átomos dos elementos. Os sete períodos, numerados sequencialmente, abrem as portas para a compreensão das intricadas camadas que circundam os núcleos atômicos.
Para evitar congestionamentos visuais, as séries dos lantanídeos e actinídeos são frequentemente destacadas, oferecendo uma visão mais clara e concisa dos elementos. Essas séries, apresentadas à parte, complementam o entendimento da estrutura complexa dos átomos além dos elementos mais comuns.
Os grupos, ou antigas famílias, constituem as colunas verticais e refletem a similaridade na disposição dos elétrons nas camadas externas. Compostos por 18 grupos numerados, essas colunas são identificadas de 1 a 18. Cada grupo abriga elementos que compartilham características químicas específicas, proporcionando uma visão organizada das propriedades dos átomos.
Dentre os grupos, destacamos alguns notáveis, como o Grupo 1A, conhecido como Metais Alcalinos, e o Grupo 2A, que abriga os Metais Alcalinoterrosos. Essas categorias delineiam a riqueza e a diversidade dos elementos e fornecem insights valiosos sobre suas interações e comportamentos químicos.
A recente revisão da numeração dos grupos pela União Internacional de Química Pura e Aplicada (IUPAC) trouxe clareza à disposição dos elementos. Essa padronização, embora consagrada, não eclipsa as referências tradicionais às famílias, identificadas por letras e números.
Essa exploração da Tabela Periódica mergulha nas nuances das camadas eletrônicas, revelando um vasto universo de informações e padrões. Enquanto desvendamos as complexidades da tabela, ressaltamos a exceção notável do hidrogênio, uma pérola solitária entre os Metais Alcalinos, devido às suas propriedades eletrônicas singulares. Ao explorar essa ferramenta poderosa, aprofundamos nosso entendimento da matéria e suas intrigantes manifestações na química.
2. Períodos e Grupos na Tabela Periódica
Decifrando a Tabela Periódica: Períodos, Grupos e Elementos Notáveis
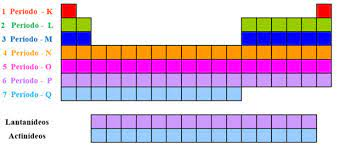
A Tabela Periódica, a cartografia da química, desdobra-se em intricados períodos e cativantes grupos, oferecendo um panorama abrangente dos elementos conhecidos. Os períodos, representados por linhas horizontais, revelam a profusão de camadas eletrônicas presentes nos átomos dos elementos, somando um total de sete períodos.
Já os grupos, outrora denominados famílias, traçam colunas verticais repletas de elementos com afinidades químicas. Essas colunas, totalizando 18 grupos, guiam-nos através de uma jornada de descobertas, destacando propriedades similares entre os átomos. Alguns desses agrupamentos merecem nossa atenção especial:
- Grupo 1 (Família 1A): Metais Alcalinos: Lítio, sódio, potássio e outros compartilham características únicas, enriquecendo nosso entendimento sobre os metais alcalinos.
- Grupo 2 (Família 2A): Metais Alcalinoterrosos: Berílio, magnésio, cálcio, entre outros, formam o grupo que nos fascina com suas propriedades distintas.
- Grupo 17 (Família 7A): Halogênios: Fluor, cloro, bromo, iodo e outros compõem essa família reativa, acrescentando camadas de complexidade à nossa análise.
- Grupo 18 (Família 8A): Gases Nobres: Hélio, neônio, argônio e criptônio, conhecidos por sua estabilidade, encerram a jornada dos grupos, oferecendo um vislumbre da harmonia na tabela.
Ao desbravarmos os períodos e grupos, mergulhamos em um oceano de informações, desvendando as nuances e conexões entre os elementos. Essa exploração nos conduz a uma compreensão mais profunda da matéria e suas complexas manifestações na química.
3. Elementos de Transição na Tabela Periódica
Explorando os Elementos de Transição: Um Olhar Detalhado na Tabela Periódica
No cenário intricado da Tabela Periódica, os elementos de transição assumem uma posição central, moldando a natureza da matéria com sua presença diversificada. Estendendo-se por diversos grupos, esses elementos oferecem uma visão rica da complexidade atômica. Alguns representantes notáveis incluem:
- Grupo 11 (Família 1B): Cobre, prata, ouro e roentgênio, desfilam por esse grupo, exibindo propriedades únicas e fascinantes.
- Grupo 12 (Família 2B): Zinco, cádmio, mercúrio e copernício compõem um conjunto de elementos que intrigam pela sua versatilidade e aplicabilidade.
- Grupo 4 (Família 4B): Titânio, zircônio, háfnio e rutherfórdio, protagonizam esse grupo, desempenhando papéis cruciais em diversas áreas.
A União Internacional de Química Pura e Aplicada (IUPAC) trouxe uma reformulação ao numerar os grupos de 1 a 18, desafiando a antiga nomenclatura das famílias. No entanto, é interessante observar que a tradição persiste, e muitos ainda se referem aos grupos pelas suas letras e números familiares.
A Tabela Periódica, esse compêndio de conhecimento químico, não é apenas uma ferramenta para os especialistas; ela se torna uma bússola orientadora para estudantes, cientistas e todos que se aventuram no vasto campo da ciência. À medida que novos elementos são desvendados e a química revela seus segredos, a Tabela Periódica continua a ser uma testemunha eloquente da evolução do nosso entendimento do mundo microscópico.
4. A Evolução da Tabela Periódica ao Longo da História
A Evolução da Tabela Periódica ao Longo da História: Um Relance nas Transformações Científicas
A Tabela Periódica, essa estrutura venerada na química, tem sua gênese marcada por uma busca incessante pela organização dos elementos de acordo com suas características inerentes. Sua evolução histórica revela um processo de refinamento contínuo, impulsionado por mentes curiosas e ávidas por compreender a complexidade dos elementos.
Antes do modelo contemporâneo, vários cientistas se empenharam na criação de tabelas que proporcionassem uma ordenação lógica dos elementos químicos. Contudo, foi Dmitri Mendeleiev, o renomado químico russo, que, em 1869, concebeu uma versão abrangente, baseando-se nas massas atômicas. Mendeleiev não apenas agrupou elementos com propriedades semelhantes, mas ousadamente reservou espaços vazios para elementos ainda não descobertos.
A configuração atual da Tabela Periódica, fundada no número atômico, foi estabelecida por Henry Moseley em 1913, revolucionando a visão proposta por Mendeleiev. A descoberta dos gases nobres por William Ramsay, incluindo neônio, argônio e criptônio, enriqueceu significativamente a Tabela Periódica, destacando a importância desses elementos na família dos gases nobres.
O legado evolutivo continuou com Glenn Seaborg, que, em 1944, trouxe à luz os elementos transurânicos e propôs uma reconfiguração ousada, diferenciando a série dos actinídeos e lantanídeos.
Em 2019, a Tabela Periódica comemorou seu 150º aniversário, uma ocasião monumental que recebeu o reconhecimento das Nações Unidas e da UNESCO como o Ano Internacional da Tabela Periódica dos Elementos Químicos. Essa celebração não apenas destacou sua relevância histórica, mas também sublinhou seu papel contínuo na compreensão da química e na decifração dos elementos que compõem o vasto universo conhecido.


