Explorando os Modelos Atômicos: Uma Jornada Pela Estrutura Subatômica
Explorando os Modelos Atômicos: Uma Jornada Pela Estrutura Subatômica
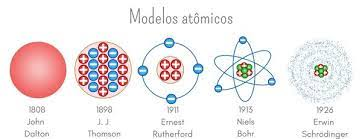
Os modelos atômicos desempenham um papel crucial na narrativa do desenvolvimento do conhecimento científico sobre a estrutura dos átomos. Ao longo do tempo, cientistas notáveis propuseram diferentes teorias na busca por decifrar os mistérios dos constituintes fundamentais da matéria. Esta exploração nos levará por uma fascinante jornada através de cinco modelos atômicos que desempenharam papéis significativos na construção do entendimento atual.
Em 1808, John Dalton introduziu o primeiro modelo atômico, conhecido como a "bola de bilhar". Esta teoria pioneira afirmava que os átomos eram esferas indivisíveis, e diferentes tipos de átomos formavam diferentes substâncias. Essencial para a compreensão moderna da estrutura atômica, o modelo de Dalton forneceu as bases para investigações posteriores.
O modelo atômico de Thomson, conhecido como o "pudim de ameixa", surgiu no final do século XIX. Thomson, ao explorar raios catódicos, propôs que os átomos eram uma mistura uniforme de carga positiva e elétrons negativos dispersos. Essa teoria desafiadora abriu caminho para uma compreensão mais profunda da estrutura interna dos átomos.
Em 1911, Ernest Rutherford realizou o famoso experimento da folha de ouro, resultando no modelo atômico de Rutherford. Esse modelo revelou um núcleo concentrado positivamente, cercado por elétrons em órbita, alterando fundamentalmente nossa visão do átomo. A partir desse ponto, a busca por um entendimento mais refinado continuou, levando ao aprimoramento do modelo por Niels Bohr e, mais tarde, ao modelo atômico de Schrodinger, que incorpora a mecânica quântica.
Essa jornada pelos modelos atômicos não apenas destaca a evolução do pensamento científico, mas também sublinha a complexidade e o fascínio subjacentes à estrutura subatômica. Esse conhecimento não só é fundamental para estudantes de ciências, mas também pode ser um diferencial valioso em avaliações acadêmicas, como o ENEM, que valorizam uma compreensão profunda dos conceitos científicos.
1. Modelo Atômico de Dalton
Desvendando o Modelo Atômico de Dalton: A "Bola de Bilhar" que Fundamentou a Ciência Atômica
Em um marco histórico em 1808, o cientista John Dalton apresentou ao mundo o primeiro modelo atômico significativo, conhecido como a "bola de bilhar". Essa teoria revolucionária propunha uma visão pioneira dos átomos, descrevendo-os como esferas indivisíveis. A proposta central do modelo de Dalton afirmava que diferentes substâncias eram formadas por diferentes tipos de átomos.
A "bola de bilhar" de Dalton não apenas visualizava os átomos como entidades indivisíveis, mas também estabelecia a base para a compreensão moderna da estrutura atômica. Sua teoria abriu caminho para uma nova era de investigação científica, desafiando concepções antigas e inspirando gerações subsequentes de cientistas.
Ao compreender o modelo atômico de Dalton, mergulhamos nas origens da ciência atômica, testemunhando a audácia de um pensador visionário que lançou as bases para as descobertas que viriam moldar a nossa compreensão fundamental da matéria. Este modelo, embora tenha sido a primeira tentativa, marcou o início de uma jornada fascinante pelos intricados mistérios da estrutura subatômica.

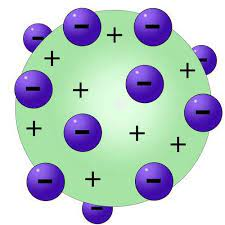
2. Modelo Atômico de Thomson
Desbravando o Modelo Atômico de Thomson: O "Pudim de Ameixa" e a Revelação Interna do Átomo
No fim do século XIX, Sir J.J. Thomson revolucionou o entendimento da estrutura atômica ao explorar os raios catódicos, apresentando ao mundo o intrigante Modelo Atômico de Thomson. Conhecido como o "pudim de ameixa", essa teoria audaciosa propunha que os átomos eram uma mistura uniforme de carga positiva e elétrons negativos dispersos.
A imagem de um "pudim de ameixa" pode parecer peculiar, mas representou uma inovação surpreendente na época. Thomson desafiou a concepção de átomos como entidades indivisíveis, revelando uma estrutura interna complexa. A sugestão de uma carga positiva uniforme e elétrons distribuídos sinalizava uma nova compreensão dos constituintes fundamentais da matéria.
Ao penetrar nas entranhas do modelo atômico de Thomson, mergulhamos em uma era de descobertas que transformaram a visão tradicional dos átomos. Esta teoria, com sua ousadia e inovação, destacou-se como um ponto de viragem crucial na jornada contínua para desvendar os mistérios da estrutura subatômica.
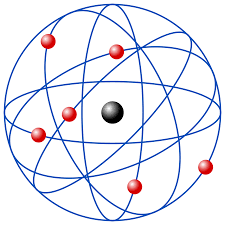
3. Modelo Atômico de Rutherford
Revolucionando a Percepção Atômica: O Experimento de Rutherford e seu Modelo Planetário
Em 1911, o renomado cientista Ernest Rutherford deixou uma marca indelével na história da física com seu notável experimento da folha de ouro, um marco fundamental para a concepção do Modelo Atômico de Rutherford. Neste experimento inovador, partículas alfa foram disparadas em uma fina folha de ouro, revelando resultados que desafiaram as expectativas e reformularam nossa compreensão da estrutura atômica.
O modelo planetário de Rutherford, emergindo desse experimento pioneiro, apresentou uma visão revolucionária do átomo. Sua proposta audaciosa indicava a presença de um núcleo central massivo e carregado positivamente, enquanto os elétrons orbitavam em torno desse núcleo em padrões semelhantes aos planetas ao redor do sol.
Essa descoberta impactante redefiniu a imagem do átomo, substituindo a concepção anterior de uma esfera maciça e indivisível. Ao desbravar o Modelo Atômico de Rutherford, somos transportados para um momento crucial na evolução do entendimento científico, onde a natureza dualística do átomo começou a ser revelada.
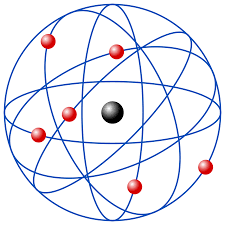
4. Modelo de Rutherford – Bohr
Refinando a Órbita Eletrônica: A Contribuição de Niels Bohr ao Modelo Atômico
O Modelo de Rutherford-Bohr surge como uma evolução natural no entendimento da estrutura atômica. Proposto por Niels Bohr, este modelo refinado introduziu conceitos inovadores que aprimoraram a compreensão do comportamento dos elétrons em torno do núcleo.
Ao incorporar a ideia de óbitas quantizadas, Bohr deu um passo além na explicação dos fenômenos atômicos. Essa abordagem inovadora não apenas endossava a estabilidade do átomo, mas também lançava luz sobre os espectros atômicos, fornecendo uma visão mais precisa e completa do movimento orbital dos elétrons.
A contribuição de Bohr não apenas solidificou o entendimento dos padrões de energia dentro do átomo, mas também estabeleceu as bases para desenvolvimentos futuros na teoria quântica. Ao explorarmos o Modelo de Rutherford-Bohr, mergulhamos nas nuances da mecânica atômica, onde a quantização das órbitas revela-se uma peça crucial no quebra-cabeça subatômico.
5. Modelo Atômico de Schrödinger
O modelo atualmente aceito, proposto por Erwin Schrödinger, incorpora a mecânica quântica. A teoria das funções de onda e orbitais eletrônicos descreve a probabilidade de encontrar elétrons em certas regiões. Esse modelo, baseado no princípio da incerteza de Heisenberg, contribuiu significativamente para nossa compreensão da estrutura atômica.
Essa viagem pelos modelos atômicos não apenas reflete a evolução do pensamento científico, mas também destaca a complexidade e fascínio subjacentes à estrutura subatômica. Esse conhecimento é crucial não apenas para estudantes de ciências, mas também pode ser um diferencial em avaliações como o ENEM, que valorizam a compreensão aprofundada de conceitos científicos.
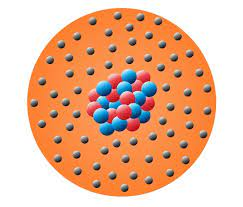
O que diz o modelo atómico de Schrödinger ?
O modelo atômico de Schrödinger traz consigo uma abordagem inovadora que mergulha nas complexidades da dualidade onda-partícula dos elétrons. Esta teoria, que tem sido objeto de estudo e análise, destaca-se pela sua interpretação matemática única, proporcionando uma visão diferenciada da estrutura atômica.
A característica fundamental deste modelo reside na substituição da tradicional trajetória bem definida do elétron por algo mais intrigante: a probabilidade de existência do elétron ao redor do núcleo. Em vez de seguir uma rota previsível, os elétrons, de acordo com o modelo de Schrödinger, apresentam uma distribuição probabilística em suas órbitas.
Explorar o modelo atômico de Schrödinger é adentrar no fascinante mundo da física quântica, onde a incerteza e a probabilidade moldam a nossa compreensão da mecânica subatômica. Este modelo desafia as concepções clássicas, proporcionando uma perspectiva única sobre a dinâmica dos elétrons nos átomos.
Como funciona o modelo atômico?
Desvendando os Segredos do Funcionamento Atômico: Uma Jornada Através dos Modelos Atômicos
Compreender o funcionamento do átomo é uma busca incessante que levou à formulação de diversas teorias ao longo do tempo. Os modelos atômicos representam o resultado dessa incansável busca, sendo elaborados por cientistas na tentativa de decifrar os mistérios da matéria e seus fenômenos.
Essas teorias, documentadas ao longo da história, têm como ponto de partida a existência da partícula fundamental: o átomo. Cada modelo atômico reflete a interpretação peculiar de sua época, ajustando-se aos conhecimentos científicos disponíveis. À medida que avançamos cronologicamente pelos modelos atômicos, testemunhamos uma evolução na compreensão do átomo, moldada pelas descobertas e avanços científicos.
Do modelo de Dalton à teoria quântica de Schrödinger, essa jornada pelos modelos atômicos é uma viagem fascinante pelos corredores da física e da química, oferecendo insights valiosos sobre a natureza fundamental da matéria.
Qual a contribuição de Schrödinger?
A Inestimável Contribuição de Schrödinger para a Teoria Quântica
Erwin Schrödinger, nascido em 1887 e falecido em 1961, deixou um legado duradouro na física quântica. Em 1924, motivado pela proposição visionária de Louis de Broglie sobre a natureza dual das partículas da matéria, Schrödinger empreendeu uma jornada intelectual que resultou em uma teoria inovadora.
A teoria desenvolvida por Schrödinger foi fundamentada na equação da propagação, também conhecida como a equação da onda. Essa formulação matemática proporcionou uma descrição sem precedentes do comportamento dos sistemas quânticos. Ao adotar uma abordagem que incorporava a dualidade onda-partícula das partículas, Schrödinger revolucionou a compreensão da mecânica quântica.
O trabalho de Schrödinger não apenas enriqueceu o campo da física teórica, mas também estabeleceu as bases para o desenvolvimento posterior da teoria quântica. Sua contribuição notável permanece como um marco significativo na exploração do mundo subatômico e continua a inspirar pesquisadores e estudiosos na busca pelo entendimento mais profundo da natureza fundamental da matéria.
Qual a Equaçao de Schrödinger ?
A equação pode ser traduzida pela seguinte expressão: onde = h/2π é a constante de Planck reduzida, ∇2o laplaciano e m a massa da partícula.

