Simulado Cinética Química para o Enem | ENEM
SIMULADO CINÉTICA QUÍMICA PARA O ENEM
INSTRUÇÕES DO SIMULADO
OBJETIVOS
Aprimorar os conhecimentos adquiridos durante os seus estudos, de forma a avaliar a sua aprendizagem, utilizando para isso as metodologias e critérios idênticos aos maiores e melhores do País, através de simulados para , provas e questões de .
PÚBLICO ALVO DO SIMULADO
Alunos/Concursando que almejam sua aprovação no ENEM.
SOBRE AS QUESTÕES DO SIMULADO
Este simulado contém questões da ENEM que foi organizado pela bancas diversas. Estas questões são de Cinética Química, contendo os assuntos de Assuntos Diversos que foram extraídas dos anteriores ENEM, portanto este simulado contém os gabaritos oficiais.
ESTATÍSTICA DO SIMULADO
O Simulado Cinética Química para o Enem contém um total de 10 questões de com um tempo estimado de 30 minutos para sua realização. Os assuntos abordados são de Cinética Química, Assuntos Diversos para que você possa realmente simular como estão seus conhecimento no ENEM.
RANKING DO SIMULADO
Realize este simulado até o seu final e ao conclui-lo você verá as questões que errou e acertou, seus possíveis comentários e ainda poderá ver seu DESEMPENHO perante ao dos seus CONCORRENTES no ENEM. Venha participar deste Ranking e saia na frente de todos. Veja sua nota e sua colocação no RANKING e saiba se esta preparado para conseguir sua aprovação.
CARGO DO SIMULADO
Este simulado contém questões para o cargo de Aluno ENEM. Se você esta estudando para ser aprovado para Aluno ENEM não deixe de realizar este simulado e outros disponíveis no portal.
COMO REALIZAR O SIMULADO ENEM
Para realizar o simulado ENEM você deve realizar seu cadastro grátis e depois escolher as alternativas que julgar correta. No final do simulado ENEM você verá as questões que errou e acertou.
Bons Estudos! Simulado para ENEM é aqui!
- #202432
- Banca
- . Bancas Diversas
- Matéria
- Cinética Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 1 -
Há processos industriais que envolvem reações químicas na obtenção de diversos produtos ou bens consumidos pelo homem. Determinadas etapas de obtenção desses produtos empregam catalisadores químicos tradicionais, que têm sido, na medida do possível, substituídos por enzimas.
Em processos industriais, uma das vantagens de se substituírem os catalisadores químicos tradicionais por enzimas decorre do fato de estas serem
- a) consumidas durante o processo.
- b) compostos orgânicos e biodegradáveis.
- c) inespecíficas para os substratos.
- d) estáveis em variações de temperatura.
- e) substratos nas reações químicas.
- #202434
- Banca
- . Bancas Diversas
- Matéria
- Cinética Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 2 -
A hematita (α-Fe2O3), além de ser utilizada para obtenção do aço, também é utilizada como um catalisador de processos químicos, como na síntese da amônia, importante matéria-prima da indústria agroquímica.
MEDEIROS, M. A. F Química Nova na Escola, São Paulo, v. 32, n. 3, ago. 2010 (adaptado).
O uso da hematita viabiliza economicamente a produção da amônia, porque
- a) diminui a rapidez da reação.
- b) diminui a energia de ativação da reação.
- c) aumenta a variação da entalpia da reação.
- d) aumenta a quantidade de produtos formados.
- e) aumenta o tempo do processamento da reação.
- #202436
- Banca
- . Bancas Diversas
- Matéria
- Cinética Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 3 -
Alguns fatores podem alterar a rapidez das reações químicas. A seguir destacam-se três exemplos no contexto da preparação e da conservação de alimentos:
1. A maioria dos produtos alimentícios se conserva por muito mais tempo quando submetidos à refrigeração. Esse procedimento diminui a rapidez das reações que contribuem para a degradação de certos alimentos. 2. Um procedimento muito comum utilizado em práticas de culinária é o corte dos alimentos para acelerar o seu cozimento, caso não se tenha uma panela de pressão. 3. Na preparação de iogurtes, adicionam-se ao leite bactérias produtoras de enzimas que aceleram as reações envolvendo açúcares e proteínas lácteas.
Com base no texto, quais são os fatores que influenciam a rapidez das transformações químicas relacionadas aos exemplos 1,2 e 3, respectivamente?
- a) Temperatura, superfície de contato e concentração.
- b) Concentração, superfície de contato e catalisadores.
- c) Temperatura, superfície de contato e catalisadores.
- d) Superfície de contato, temperatura e concentração.
- e) Temperatura, concentração e catalisadores.
- #202437
- Banca
- . Bancas Diversas
- Matéria
- Cinética Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 4 -
A nanotecnologia pode ser caracterizada quando os compostos estão na ordem de milionésimos de milímetros, como na utilização de nanomateriais catalíticos nos processos industriais. O uso desses materiais aumenta a eficiência da produção, consome menos energia e gera menores quantidades de resíduos. O sucesso dessa aplicação tecnológica muitas vezes está relacionado ao aumento da velocidade da reação química envolvida.
O êxito da aplicação dessa tecnologia é por causa da realização de reações químicas que ocorrem em condições de
- a) alta pressão.
- b) alta temperatura.
- c) excesso de reagentes.
- d) maior superfície de contato.
- e) elevada energia de ativação.
- #202438
- Banca
- . Bancas Diversas
- Matéria
- Cinética Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 5 -
O peróxido de hidrogênio é um produto secundário do metabolismo celular e apresenta algumas funções úteis, mas, quando em excesso, é prejudicial, gerando radicais que são tóxicos para as células. Para se defender, o organismo vivo utiliza a enzima catalase, que decompõe H2O2 em H2O e O2 . A energia de reação de decomposição, quando na presença e ausência da catalase, está mostrada no gráfico.
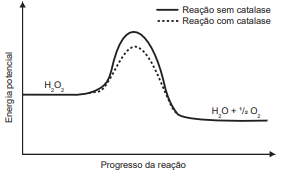
Disponível em: www.pontociencia.org.br. Acesso em: 14 ago. 2013 (adaptado).
Na situação descrita, o organismo utiliza a catalase porque ela
- a) diminui a energia de ativação.
- b) permite maior rendimento da reação.
- c) diminui o valor da entalpia da reação.
- d) consome rapidamente o oxigênio do reagente.
- e) reage rapidamente com o peróxido de hidrogênio.
- #202439
- Banca
- . Bancas Diversas
- Matéria
- Cinética Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 6 -
Os pesticidas organoclorados foram amplamente empregados na agricultura, contudo, em razão das suas elevadas toxicidades e persistências no meio ambiente, eles foram banidos. Considere a aplicação de 500 g de um pesticida organoclorado em uma cultura e que, em certas condições, o tempo de meia-vida do pesticida no solo seja de 5 anos.
A massa do pesticida no decorrer de 35 anos será mais próxima de
- a) 3,9 g.
- b) 31,2 g.
- c) 62,5 g.
- d) 125,0 g
- e) 250,0 g.
- #202440
- Banca
- . Bancas Diversas
- Matéria
- Cinética Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 7 -
Industrialmente é possível separar os componentes do ar, utilizando-se uma coluna de fracionamento. Com este processo, obtêm-se gases como: oxigênio (O2), nitrogênio (N2) e argônio (Ar). Nesse processo o ar é comprimido e se liquefaz; em seguida ele é expandido, volta ao estado gasoso e seus componentes se separam um a um.
A ordem de separação dos gases na coluna de fracionamento está baseada em qual propriedade da matéria?
- a) Na densidade dos gases, ou seja, o menos denso separa-se primeiro.
- b) Na pressão parcial dos gases, ou seja, o gás com menor pressão parcial separa-se primeiro.
- c) Na capacidade térmica dos gases, ou seja, o gás que mais absorve calor separa-se primeiro.
- d) Na condutividade térmica dos gases, ou seja, o gás que mais rápido absorve calor separa-se primeiro.
- e) Na temperatura de ebulição dos gases, ou seja, o gás com menor temperatura de ebulição separa-se primeiro.
- #202441
- Banca
- . Bancas Diversas
- Matéria
- Cinética Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 8 -
A minimização do tempo e custo de uma reação química, bem como o aumento na sua taxa de conversão, caracterizam a eficiência de um processo químico. Como consequência, produtos podem chegar ao consumidor mais baratos. Um dos parâmetros que mede a eficiência de uma reação química é o seu rendimento molar (R, em %), definido como

em que n corresponde ao número de mols. O metanol pode ser obtido pela reação entre brometo de metila e hidróxido de sódio, conforme a equação química:
CH3Br + NaOH → CH3OH + NaBr
As massas molares (em g/mol) desses elementos são: H = 1; C = 12; O = 16; Na = 23; Br = 80.
O rendimento molar da reação, em que 32 g de metanol foram obtidos a partir de 142,5 g de brometo de metila e 80 g de hidróxido de sódio, é mais próximo de
- a) 22%.
- b) 40%.
- c) 50%.
- d) 67%.
- e) 75%.
- #202442
- Banca
- . Bancas Diversas
- Matéria
- Cinética Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 9 -
O gás hidrogênio é considerado um ótimo combustível — o único produto da combustão desse gás é o vapor de água, como mostrado na equação química.
2 H2 (g) + O2 (g) → 2 H2O (g)
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
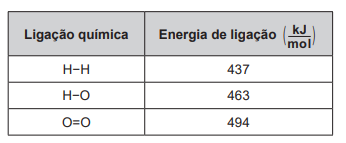
Massas molares ( g/mol ): H2 = 2; O2 = 32; H2O = 18.
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
- a) −242 000
- b) −121 000
- c) −2 500
- d) +110 500
- e) +234 000
- #202443
- Banca
- . Bancas Diversas
- Matéria
- Cinética Química
- Concurso
- ENEM
- Tipo
- Múltipla escolha
- Comentários
- Seja o primeiro a comentar
(1,0) 10 -
A combustão completa de combustíveis fósseis produz água e dióxido de carbono (CO2, massa molar 44 g mol−1). A União Europeia estabeleceu, desde 2012, limite de emissão veicular de 130 g de CO2 por quilômetro rodado (valor aplicável a uma média de veículos de um mesmo fabricante), tendo como penalidade multa, caso o fabricante ultrapasse a meta. A gasolina é uma mistura de hidrocarbonetos com cerca de oito carbonos em sua composição, incluindo isômeros do octano (C8H18). Considere que em uma cidade o consumo médio diário dos carros de um fabricante seja de 10 km L−1 de gasolina, formada apenas por octano (massa molar 114 g mol−1) e que sua densidade seja 0,70 kg L−1 .
A diferença de emissão de CO2 dos carros desse fabricante em relação ao limite estabelecido na União Europeia é
- a) 80% menor.
- b) 60% menor.
- c) 46% menor.
- d) 108% maior
- e) 66% maior.

